口服片剂新产品研发转生产中的工艺与注意事项

程呈 雷婷 马岩 王文文
山东鲁抗医药股份有限公司
一、引言
口服片剂因具有剂量准确、服用方便、稳定性好等优点,在药品市场中占据重要地位,但产品研发转生产并非易事,合理且准确的工艺参数不仅能确保产品质量符合标准,还能提高生产效率,降低生产成本。本文主要阐述口服片剂新产品研发转生产中工艺参数的确认及注意事项。
二、生产工艺阶段划分及关键任务
1. 预处理阶段
预处理阶段是口服片剂生产的起始环节,主要任务是对物料进行检查核对、粉碎、过筛、混合、整粒,确保物料符合生产要求。
1.1 物料的检查核对
物料的质量直接影响到最终产品的质量,须严格按照质量标准对物料进行核对检查,确保其合格。
1.2 物料的粉碎
粒度较大的物料,需要进行粉碎处理,使其粒度达到生产工艺的要求。主要的粉碎方式有机械粉碎、气流粉碎和使用介质粉碎等。不同的粉碎方式可以将物料粒径处理至 0.01~400μm
1.3 物料过筛
对物料的粒径范围有一定要求且粒度范围 50~400μm 的物料,可采用这种方式筛选出所需粒径范围的物料。
1.4 物料混合
对个别物料可采用与其他结构有包容性的物料进行预混和吸附。
1.5 物料整粒
对容易聚团、静电严重的物料可采用整粒机或摇摆式颗粒机整粒。
2. 混合阶段
含预混合和总混混合,需考虑设备类型、时间、速度等参数,保证物料均匀。
2.1 预混合
根据预混目的不同使用不同的设备,如混合机、摇摆式颗粒机等可用于物料更好地吸附;高位湿法混合机用于原辅料混合,保证含量混合均一性,整粒机用于易结块物料的预混合;或者使用辅料润洗设备,减少原料损失,如沸腾床预混合。
2.2 总混混合
总混混合是为了保证物料的均一性、流动性等进行的混合,不同设备之间需考虑物料的混合维度和物料流动的线速度等。
2.3 混合关键参数
在混合过程中,需要考虑混合设备的类型、混合时间、混合速度、混合料斗的装载量等参数。应根据物料的特性选择合适的不同类型的混合设备(如 V 型混合机、双锥混合机等)。在混合过程中,混合时间非常重要,若混合时间过短,物料混合不均匀;混合时间过长,则可能导致物料过度混合,产生分离现象。混合速度也需要合理控制,过快的速度可能会使物料产生静电,物料未能充分流动开,影响混合效果。此外,还需注意物料的加入顺序,合理的加入顺序有助于提高混合的均匀性。
2.4 混合取样与验收标准
2.4.1 混合取样方法
在混合设备中至少选取 10 个取样点,每个取样点至少取 3 份混合样品。单份样品取样量通常应在 1-3 倍单位剂量范围内,样品应全量用于混合均匀度检测。对于常见的滚筒式混合设备(如方锥型混合机、V-型混合机、双锥型混合机),取样点应至少分布在混合物料的上、中、下三层及卸料区域,见图1。
图1. 常见的滚筒式混合设备的取样点分布
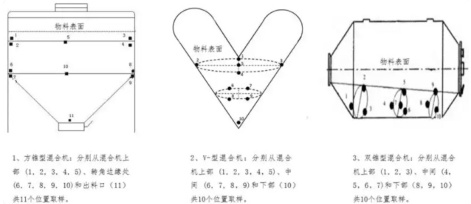
2.4.2 混合验收标准
上述每个取样点检测一个样品,计算所有样品的相对标准偏差(RSD),所有单值在均值的 ±10.0% (绝对)以内。若RSD ⩽5.0% ,则说明混合较均匀;若 RSD>5.0% ,则需要检测剩余所有样品的混合均匀度,若仍然 RSD>5.0% ,则需进行调查,以确定变异性是否由产品 /工艺问题或取样/ 分析误差引起的。
3. 制粒阶段
制粒是将混合后的物料制成具有一定粒度和形状颗粒的过程,常见的制粒方法有湿法制粒、干法制粒、沸腾床一步制粒等,各方法关键参数不同,对颗粒质量的影响不同。
3.1 湿法制粒
关键工艺参数包括粘合剂的种类与用量,加液速度、加液方式,制粒速度、搅拌速度、物料装量等,关键工艺参数影响物料的混合均匀性和颗粒的大小,需要根据实际情况进行调整。通过控制这些参数,可制得粒度均匀、流动性好、可压性强的颗粒,为后续的压片工序奠定基础。
3.2 干法制粒
适用于对温度和湿度不够稳定的物料,主要通过调整压辊压力,控制颗粒的硬度,再使用2 级整粒筛网控制物料的粒度。
3.3 沸腾床一步制粒
制粒温度、物料沸腾状态和粘合剂种类、用量和喷液速度、喷液压力、喷枪位置均会影响制粒效果。温度过高可能导致物料中有效成分的分解,温度过低则可能影响颗粒的干燥效果。物料的沸腾状态直接影响制粒的效果和颗粒的细度和粒度。粘合剂的种类、用量和喷液速度、喷液压力、喷枪位置会影响制粒效果、颗粒的硬度、大小等。
4. 压片阶段
压片是将颗粒状物料压制成具有一定形状和硬度片剂的过程。压片过程中的关键工艺参数包括预压压力、主压压力、压片速度、供料靴速度、冲模的规格与质量、充填量等。压力工艺参数直接影响片剂的硬度和崩解时限等质量属性。压力过大,片剂过硬,崩解时间延长,影响药物的溶出和吸收;压力过小,片剂硬度不够,容易出现裂片、松片等问题。供料靴转速、压片速度,过快的压片速度匹配较慢的供料靴转速可能导致片剂质量不稳定,如片重差异不合格等,过慢的压片速度匹配较快的供料靴转速可能导致颗粒粒度被破坏、出现物料分层,过混合等现象,如中控剂量均匀度不合格等。冲模的规格决定了片剂的形状和大小,其质量则影响片剂的外观和质量,冲模表面不光滑、有磨损等问题可能导致片剂表面出现划痕、粘冲等现象。
5. 包衣阶段
包衣的目的是改善片剂的外观、掩盖药物的不良气味、提高药物的稳定性、控制药物的释放速度等。
5.1 包衣参数的确认
包衣工艺可分为糖衣包衣和薄膜包衣等。以薄膜包衣为例,关键工艺参数包括包衣液的配方、包衣温度、包衣片在锅内的流动状态、喷枪的压力,喷液速度和喷液角度等。
5.1.1 包衣锅的大小和喷枪支架安装
喷枪的压力和角度影响包衣液的雾化效果和喷涂均匀性,需要进行精确调整。主支架:按照左右距离固定;竖杆:根据片床距离调整,25-30cm 最佳(枪头距流动片床的距离);横杆:按照左右距离固定;温度传感器:根据现场情况调整。确保喷液状态能够保证包衣的均匀性。
5.1.2 包衣参数确认
包衣温度、包衣片在锅内的流动状态和喷液速度影响包衣膜的均匀性和干燥效果,温度过高或速度过快,可能导致包衣膜出现皱皮、起泡等问题;温度过低或速度过慢,容易出现粘片风险,延长包衣时间。
预热阶段控制滚筒转速、热风温度、产品温度等工艺参数;包衣阶段控制滚筒转速、热风温度、蠕动泵转速、锅内负压、雾化气压、产品温度、进风风量等;干燥阶段控制滚筒转速、热风温度、干燥时间;冷却阶段控制产品温度。
5.1.3 包衣液配方
包衣液的配方决定了包衣膜的性能,如成膜性、防潮性、释药性能等。选择包衣预混剂时需结合制剂特性、工艺需求、质量目标及法规要求综合评估,具体如下:
5.1.3.1 明确包衣目的,匹配功能需求包衣的核心目的决定预混剂的基础功能,需先明确包衣的目的。
a 为掩味 / 遮臭:需选择含遮光性辅料(如二氧化钛)、成膜后密封性好的预混剂。b 防潮 / 防氧化:优先选择水不溶性或低水溶性成膜材料(如乙基纤维素),或含阻湿成分(如甘油三酯)的预混剂。c 控释 / 缓释:根据释药机制(如膜控型、渗透型)选择对应的成膜材料,如乙基纤维素(缓释)、醋酸纤维素(控释)。d 改善外观 / 标识:需考虑预混剂的光泽度、着色均匀性,以及与色素的相容性(避免迁移、褪色)。e 防潮 / 隔离:对于易水解或与包衣层成分反应的药物,需选择惰性成膜材料(如羟丙甲纤维素)作为隔离层预混剂。
三、研发转生产实验设计
1. 处方、生产流程研究
可以通过查官方网站资料,如说明书、专利等方式确认目标产品处方和简易生产流程,也可以通过先进设备对参比制剂进行反向剖析,分析出产品成分,推测生产工艺。
2. 关于物料的粒径选择
物料的粒径影响成品的溶出度、与参比制剂溶出曲线的相似性、物料的流动性、可压性等内外在指标,也可能影响临床疗效。不同的物料可选择不同处理方式控制粒度分布。


3. 关于混合均一性终点判断
一种判断混合均匀性终点的方法主要有:先取一个经验值确定混合转速和混合时间,再根据经验值设定混合范围,通过多次混合均匀度检测确认混合效果和混合参数。还可在工艺开发过程中运用过程分析技术系统(PAT)技术进行终点判断。
4. 关于压片参数设计和取样确认
压片主要控制供料靴速度、主压、预压、生产速度等,工艺参数的设计取决于对基片的关键质量属性要求,其取样计划要涵盖需要考察的所有关键质量属性,并确认关键质量属性与关键工艺参数的匹配性,需涵盖中控剂量均匀度、性状、片重差异、硬度、崩解时限、脆碎度、溶出度等。
5. 关于包衣片溶出曲线对比的要求
需至少在 3 种不同 pH 介质中进行溶出曲线对比,以评估包衣片在不同环境下的释放行为。同时应关注溶出曲线的相似因子(f2)和差异因子(f1)计算,确保包衣片与参比制剂在关键溶出阶段具有可比性。此外,还需对包衣增重、衣膜厚度及包衣工艺参数进行系统考察,以保证产品批间一致性和稳定性。溶出曲线对比结果应能支持后续生物等效性预测及质量可控性评价。
四、研发转生产质量评价体系和中试放大注意事项
1. 质量评价体系
建立全面的质量评价指标体系,质量评价指标应涵盖物理性质(如片重差异、硬度、脆碎度、崩解时限等)、化学性质(如有效成分含量、含量均匀度等)以及微生物限度等方面。
2. 中试放大注意事项
在实验室小试确定初步工艺参数后,进行中试放大实验。在中试过程中,要密切观察生产过程中的各种现象,如颗粒状态、物料的流动性、设备的运行情况等,及时记录产品质量数据。与小试结果进行对比分析,对工艺参数进行进一步的调整和优化,确保工艺参数能够适用于商业化生产。中试后进入GMP 管控流程时需注意以下事项:
2.1 风险管控
2.1.1 质量风险:在生产过程中,物料质量波动、工艺参数失控设备故障等因素都可能导致产品质量问题。需要建立完善的质量风险管
理体系,对可能影响产品质量的风险因素进行识别、评估和控制。
2.1.2 安全风险:口服片剂生产过程中可能涉及到危险化学品,需针对该危险化学品进行职业健康安全培训。
2.2 资源协调
研发转生产过程需要不同专业背景的人协同工作,需对人力、设备、物料等等多方资源进行协调汇总,分工统筹安排。
2.3 工艺验证
在研发转生产过程中,必须按照相关法规和指南的要求进行工艺验证。根据产品的特点和生产工艺的复杂程度选择合适的验证方式。通过工艺验证,进一步确认工艺参数的合理性和稳定性,确保生产工艺能够始终如一地生产出高质量的产品。
2.4 文件管理
建立完善的文件管理体系,对生产过程中的各种文件进行规范管理。文件应包括工艺规程、操作规程、质量标准、检验记录、生产记录等。文件的编写应符合相关法规和企业的实际情况,内容要准确、清晰、完整。文件的发放、使用、回收和存档要进行严格管理,确保文件的有效性和可追溯性。通过文件管理,为生产过程的规范化管理和质量追溯提供依据。
五、结论
口服片剂新产品研发转生产中工艺参数的确认是一个复杂而关键的过程,涉及到多个生产环节和众多影响因素。通过对预处理、混合、制粒、压片、包衣等各阶段关键工艺参数的准确确认和优化,以及对研发转生产过程中风险管控、资源协调、工艺验证、文件管理等注意事项的有效把握,可以提高口服片剂新产品研发转生产的成功率,保障产品质量的稳定性和一致性,实现口服片剂新产品的顺利产业化生产。在实际工作中,应不断总结经验,结合新技术、新方法,持续改进工艺参数和生产管理水平,推动口服片剂产业的高质量发展。
参考文献
[1] 《化药口服固体制剂混合均匀度和中控剂量单位均匀度研究技术指导原则 ( 试行 )》 2022 年 01 月
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)