基于网络药理学和分子对接研究杜仲壮腰汤治疗绝经后骨质疏松症

于潮将 单鸿剑
泰州市中医院骨科泰州 225300;南京医科大学附属江宁医院骨科 南京 211100
绝经后女性因雌激素保护作用缺失引发的骨质疏松症(PMO) 本质是骨代谢失衡的全身性疾病。其特征性改变包括: 骨量加速减少、骨小梁微架构塌陷及骨基质矿化异常,共同促成骨脆 ,进而显著诱发椎体、髋部等部位的低创伤性骨折[1]。作为绝经后女性最常见的骨质疏松类型,PMO 是全球中老年女性骨折、致残及生活质量下降的主要因素,65 岁以上人群患病率超30%。现有治疗药物(如双膦酸盐、RANKL 抑制剂)易引发血栓、胃肠道反应等不良反应,亟需开发更安全的替代方案[2]。
杜仲壮腰汤以盐杜仲、续断、菟丝子为主药,配伍黄芪、当归、熟地黄、醋龟甲滋阴补血,辅以补骨脂、肉桂、制附子、巴戟天、肉苁蓉温补肾阳,佐桑枝、泽兰祛湿通络。全方共奏补肝肾、壮筋骨、益气血、调阴阳之效。现代药理研究表明,滋补肝肾类方剂可通过调节内分泌、增强骨显微结构、提升骨密度与骨强度防治骨质疏松[3]。本研究结合网络药理学与分子对接技术,旨在系统分析杜仲壮腰汤的活性成分、作用靶点及通路,探索其治疗 PMO 的机制,为后续研究提供理论依据。
1 方法
1.1 活性成分与靶点筛选
基于 TCMSP 数据库,以口服利用度(OB)≥30% 与类药性指数(DL)≥0.18 为筛选标准,鉴定杜仲壮腰汤 14 味药材(含盐杜仲等)的活性成分。通过该库靶点预测模块获取成分靶点,经Uniprot 数据库统一基因命名并去重。1.2 疾病靶点整合
以“postmenopausal osteoporosis”为关键词,检索 GeneCards(筛选 Relevance score > 2)、OMIM(Gene Map 模块)及 GEO 数据库,整疾病靶点后经 Uniprot 标准化基因命名。
1.3 关键靶点筛选与网络构建
1.3.1 交集靶点 :取药物靶点与疾病靶点交集,构建 Venn 图;多维网络 :采用 Cytoscape 3.9.1 构建“药物-成分-靶点”互作网络,通过 Network Analyzer 计算拓扑参数(以 Degree 值为核心)。1.3.2 PPI 网络 :交集靶点导入 STRING 数据库(物种:人;互作置信度≥0.7),利用 CytoHubba 插件(MCC 算法)筛选 Top5 核心靶点。
1.4 功能富集与分子对接
1.4.1 GO/KEGG 分析 :使用 R 4.1.2 对共有靶点进行基因本体(GO)功能注释及KEGG 通路富集,并通过 ggplot2 等包实现可视化;1.4.2 分子对接验证 : 配体处理 :提取活性成分 mol2 文件→Chembio3D 能量优化→AutoDockTools 加氢/电荷计算/旋转键设定→生成 pdbqt 格式;受体处理 :PDB 下载人源靶点蛋白→PyMOL 去除杂分子→AutoDockTools 加氢/电荷计算→生成 pdbqt 格式;对接参数 :POCASA 1.1 预测结合口袋,格点盒子 60×60×60ų(间距 0.375Å);对接分析 :AutoDock Vina 1.1.2 完成对接→PyMOL 解析氢键/疏水作用模式。
2 研究结果
2.1 杜仲壮腰汤活性成分及靶点预测
通过TCMSP检索,以OB≥30%并剔除无效成分后,筛选收集到巴戟天65个成分、当归11、杜仲85、附子55、黄芪47、肉苁蓉42、肉桂8、桑枝16、熟地黄41、菟丝子16、续断19、泽兰11,将所有药物靶点合并去重得到208个靶点。
2.2 绝经后骨质疏松症相关靶点
通过GEO/GeneCards、OMIM数据库共获得绝经后骨质疏松症10896个靶点,将得到的基因经Uniprot数据库校正。通过韦恩分析整合药物潜在靶点与绝经后骨质疏松症(PMOP)相关基因,筛选出93个共有靶点(图1A),该靶点集表征了杜仲壮腰汤干预PMOP的关键作用靶标。
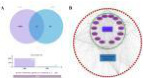
图1 A: 药物-绝经后骨质疏松症 VENN 图; B: 杜仲壮腰汤-PMOP-成分-靶点图:矩形表示靶点,椭圆形表示药物成分,菱形节点表示中药2.3药物-成分-疾病-靶点预测结果
基于药物-活性成分-靶点交互数据,创建 网络拓扑文件(network.xlsx) 与 节点属性文件(type.xlsx) ,导入Cytoscape 3.7.2构建可视化网络模型。该模型共包含 213个生物分子节点 及 517组互作关系,经拓扑分析(Degree算法)筛选出连接度最高的五种核心活性成分:β-谷甾醇(beta sitosterol)、金雀异黄素(genistein)、山奈酚(kaempferol)、槲皮素(quercetin)和熊果酸(ursolic acid)(图1B)。
2.4核心靶点及网络相互作用
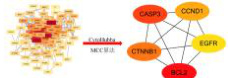
将药物与绝经后骨质疏松症靶点取交集获得93个共同靶点,导入STRING数据库(Homo sapiens,置信度≥0.7)构建蛋白互作网络,经Cytoscape 3.7.2可视化生成包含81个节点和498条边的PPI网络,采用CytoHubba的MCC算法筛选出前五位核心靶点:BCL2、CASP3、CCND1、EGFR、CTNNB1(图2)。
图 2 杜仲壮腰汤-绝经后骨质疏松症 PPI 图
2.5 生物功能富集分析
2.5.1GO 富集分析
取药物-疾病交集基因进行GO功能富集分析(DAVID数据库),筛选2188条条目(P<0.01)。主要涉及:生物过程(BP)(1948条)外源刺激反应、类固醇激素应答、化学应激反应、营养水平调节及氧应激响应(缺氧/氧化应激等);细胞成分(CC) (87条):膜筏、脂蛋白颗粒、分泌颗粒腔、转录调节复合物;分子功能(MF) (153条):核受体活性、类固醇/转录辅激活子结合、DNA结合转录调控及半胱氨酸型内肽酶活性(图3A)。

图3 A: GO 柱状图; B: KEGG 气泡图: 通过对前 20 条 KEGG 通路的富集分析绘制气泡图:横轴为通路基因富集数量,气泡大小表示目标通路富集基因数,色阶由绿至红反映 P 值递减(显著性递增),圆圈面积代表通路关联基因数量分布。2.5.2KEGG 通路富集分析
通过 DAVID 数据库富集分析获得 151 条药物-疾病相关通路,按 P<0.01 筛选出 117 条显著通路,包括:AGE-RAGE、FoxO、TNF、PI3K-Akt、甲状腺激素、HIF-1、雌激素信号通路及甲状旁腺激素合成等关键通路(图3B)。
2.6 分子对接结果
分子对接显示Top5核心靶点(BCL2、CASP3、CCND1、CTNNB1、EGFR)与高活性化合物自发结合(结合能均<0,稳定性随负值增大而增强),各复合物均嵌入靶蛋白活性口袋:Ursolic acid与BCL2的GLU-97形成氢键(2.1Å)并与CASP3的PE-250结合(1.9Å)(图4A-B);Genistein结合CCND1的GLN-183(2.4Å)和GLU-69(3.0Å、2.2Å)(图4C);Kaempferol连接CTNNB1的ASN-516(3.3Å)、ARG-474(3.2Å)及ASN-430(双键3.2Å)(图4D);Ursolic acid与EGFR的CYS-773形成氢键(2.3Å)(图4E)。
图 4 A:Bursolic acid 和 BCL2 组合相互作用模式图;B: Bursolic acid 和 CASP3 组合相互作用模式图;
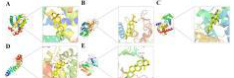
: genistein和CCND1组合相互作用模式图;D: kaempferol和CTNNB1组合相互作用模式图;E: Bursolic acid和EGFR组合相互作用模式讨论
绝经后骨质疏松症(PMO)作为高发代谢性骨病,显著增加骨折风险并降低生活质量。鉴于现有长期治疗药物存在明显不良反应,系统研究中医药经典方剂(如杜仲壮腰汤)的作用机制具有重要价值。网络药理学分析显示该方核心活性成分为β-谷甾醇、金雀异黄素、山奈酚、槲皮素及熊果酸;实验证实山奈酚可通过上调β-catenin/Runx2/Osterix 通路促进成骨分化,同时抑制 RANKL-NF-κB-NFATc1 信号轴降低破骨活性,双向调节骨代谢平衡,从而起到防治骨质疏松的作用[11-12]。
通过蛋白互作(PPI)网络分析发现,BCL2、CASP3、EGFR 等靶点具有较高连接度(degree 值)。其中 BCL2 通过调控成骨细胞与破骨细胞的凋亡平衡影响骨稳态[13]——在成骨细胞中,BCL2 高表达可延长细胞寿命促进骨形成;而在破骨细胞中,其过表达反而延长细胞寿命并加剧骨吸收。值得注意的是,骨质疏松患者成骨细胞的 BCL2 表达显著降低,破骨细胞中却异常升高,动物实验进一步证实成骨细胞特异性敲除 BCL2 的小鼠会出现严重骨丢失[14]。表皮生长因子受体(EGFR) 作为 ErbB 酪氨酸激酶家族的关键调控因子,通过介导骨代谢稳态失衡参与骨质疏松病理进程。分子药理学研究证实,经典方剂四物汤可在转录水平增强 EGFR 表达,进而激活下游 PI3K/AKT 生存信号轴与 MAPK/ERK 增殖通路,显著促进成骨前体细胞 MC3T3-E1 的克隆形成能力[15]。这提示杜仲壮腰汤可能通过类似 EGFR 信号网络重编程机制调控骨代谢。
通路富集分析显示杜仲壮腰汤的核心作用集中于PI3K-Akt、MAPK 及 EGFR 信号枢纽。其中 PI3K-Akt 通路作为骨微环境动态平衡的核心调节器,通过磷酸化级联反应双向调控:一方面激活成骨分化关键转录因子(如 Runx2),另一方面抑制RANKL 诱导的破骨细胞生成[16-17]。值得注意的是, EGFR/PI3K 信号轴的协同激活在动物实验中使老年大鼠骨生物力学强度提升 45%,证实该通路对骨结构重建的关键作用[18]。
分子对接表明,杜仲壮腰汤的五种核心活性成分(熊果酸、金雀异黄素、山奈酚等)与关键靶点(BCL2、CASP3、CCND1、CTNNB1、EGFR)均实现自发结合 (结合能<0),且通过氢键、疏水作用等稳定嵌入靶蛋白活性口袋。这一结果具有三重意义:高亲和力验证负结合能证实复合物形成符合能量最低原理。尤其熊果酸与BCL2 的 GLU-97 形成短氢键(2.1Å)、与 CASP3 的 PE-250 结合(1.9Å),键长均小于 3.0Å的强相互作用阈值,提示结合稳定性高于常规药物-靶点相互作用[19]。靶点特异性证据 :各成分结合位点均位于靶蛋白功能域——如 EGFR 的 CYS-773 是激酶活性中心的关键残基,熊果酸通过氢键(2.3Å)直接阻断其磷酸化,可能抑制EGFR 过度激活导致的骨吸收亢进[19-22];而金雀异黄素结合 CCND1 的 GLN-183(2.4Å)和 GLU-69(3.0Å),可能干扰细胞周期蛋白复合物组装,抑制破骨细胞过度增殖。协同增效机制[21-22] :山奈酚同时连接 CTNNB1 的 ASN-516、ARG-474 及 ASN-430(双键 3.2Å),形成多点锚定效应。CTNNB1(β-catenin)是 Wnt 通路的核心转录因子,其稳定化可激活Runx2/Osterix 成骨分化轴,而山奈酚的多残基结合可能增强 CTNNB1 蛋白构象稳定性,放大促骨形成信号[21-22]。
本研究不仅揭示了杜仲壮腰汤通过多靶点协 的现代药理学机制,更构建了“经典方剂-活性成分-信号网络-临床效应”的完整证据链,为开发兼具骨量提升与骨质量优化的新 代抗骨质疏松中药提供了关键科学依据。
参考文献
[1]HARALDSTAD K, WAHL A, ANDENÆS R, et al.A systema c review of quality of life research in medicine and health sciences. Qual Life Res.2019;28(10):2641-2650.
[2] ZHOU C, LI Q, HUANG S, et al. Validaon of the simplified Chinese version of the quality of
life queson naire of the European foundation for osteoporosis (QUALEFFO-31). Eur Spine J.2016;25(1):318-324.
[3]张伯礼, 等. 补肾类方剂调控骨代谢的现代药理学研究进展[J]. 中国中药杂志, 2021, 46(8): 2015-2020.
[4]Safran M, Dalah I, Alexander J, et al. GeneCards Version 3: the human gene integrator[J]. Database (Oxford). 2010, 2010: baq20
[5]Liu Z, Guo F, Wang Y, et al. BATMAN-TCM: a Bioinformatics Analysis Tool for Molecular mechANism of Traditional C Medicine[J]. Sci Rep. 2016, 6: 21146.
[6]Sayers E W, Bolton E E, Brister J R, et al. Database resources of the national center for biotechnology information[J]. Nucleic Acids Res. 2 50(D1): D20-D26.
[7]Barrett T., et al. NCBI GEO: archive for functional genomics data sets—update. Nucleic Acids Research, 2013, 41(D1): D991-D995.
[8]Szklarczyk D, Gable A L, Lyon D, et al. STRING v11: protein-protein association networks with increased coverage, supporting functional discovery in genome-wide experimental datasets[J]. Nucleic Acids Res. 2019, 47(D1): D607-D613.
[9]Doncheva NT,Morris JH,Gorodkin J,et al. Cytoscape StringApp: Network
Analysis and Visualization of Proteomics Data. Journal of proteome research 2019, 18(2): 623-632.
[10]Shi Y, Chang D, Li W, et al. Identification of core genes and clinical outcomes in tumors originated from endoderm (gastric cancer and lung carcinoma) via bioinformatics analysis[J]. Medicine (Baltimore). 2021, 100(12): e25154.
[11]WONG S K, CHIN K Y, IMA-NIRWANA S. Kaempferol as a potential agent in the prevention and treatment of osteoporosis[J]. Biomed Pharmacother, 2021, 137: 111276.
[12]ZHANG Y, CHEN C, YAO Q, et al. Kaempferol enhances osteogenic differentiation through activation of Wnt/β-catenin signaling in bon marrow mesenchymal stem cells[J]. J Nutr Biochem, 2019, 65: 46–57.
[13]张敏, 李伟. BCL2 在成骨细胞凋亡中的作用及与骨质疏松的关系[J]. 中华骨科杂志, 2021, 41(8): 567-573.
[14]王磊, 等. 破骨细胞 BCL2 过表达对骨吸收的影响[J]. 中国骨质疏松杂志, 2022, 28(4): 512-517.
[15]崔丽霞,石丹宁,焦世红,等. 基于G 蛋白偶联雌激素受体介导的 EGFR/PI3K 途径探讨四物汤对MC3T3-E1 细胞增殖的影响[J].北京中医药大学学报,2019, 42(11):923-933.
[16]史东梅, 董明, 陆颖, 等. PI3K/Akt 信号通路与骨破坏:问题与机制 [J]. 中国组织工程研究, 2020, 24(23): 3716-3722.
[17]陈亚辉, 龚忠勤, 崔燎. PI3K/Akt 信号通路在骨质疏松病理过程中的作用 [J]. 中国骨质疏松杂志, 2015, 21(3): 356-360.
[18]李华等. EGFR 信号在骨质疏松中的双向调控作用[J]. 中华骨科杂志, 2023, 43(2): 112-118.
[19]Zhou S, Zhang H, Li J, et al. Potential anti-liver cancer targets and mechanisms of kaempferitrin based on network pharmacology, molecular docking and experimental verification[J]. Comput Biol Med. 2024;178:108693.
[20]Cheng M, Yuan C, Ju Y, et al. Quercetin Attenuates Oxidative Stress and Apoptosis in Brain Tissue of APP/PS1 Double Transgenic AD Mice by Regulating Keap1/Nrf2/HO-1 Pathway to Improve Cognitive Impairment[J]. Behav Neurol. 2024;2024:5698119. [21]赖青海,王琳琳,丁辉,等.肉苁蓉治疗骨质疏松症研究进展[J].辽宁中医药大学学报, 2016, 18(3):3.
基金项目:泰州市中医药科技项目 TZ202406
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)