乳腺癌 3D-HDRA 检测与新辅助化疗疗效的相关性研究

杨艳萍
邵阳市中心医院 湖南 邵阳 422000
前言
随着医学技术的不断发展,人类提出采用新辅助化疗治疗癌症。临床实践以及诸多研究结果均表明此方法能够缓解癌症,效果确切。对于癌症患者,此疗法与预后存在一定联系,尤其对于乳腺癌患者群体而言,新辅助化疗后的病理完全缓解有助于改善预后效果。有学者指出,将各种先进的检测技术用于评价新辅助化疗结果是非常必要的,此举可为后续治疗提供指导,提高医疗质量 [1]。对比 3D-HDRA 检测与新辅助化疗结果,可明确该检测方法评价新辅助化疗疗效的可行性和有效性。截至目前,新辅助化疗的疗效评价具体包含两个方面,分别是临床评价和病理评价;前者是一种有创检测方法,会给患者带来不适,故而不适合反复进行;后者的优势是无创、易于实施,目前应用较广泛的是超声检测和体检 [2]。除了上述几种方法外,3D-HDRA 检测在临床上也较为常用。其核心思想是基于相关指标对患者的化疗疗效进行评价,具有效率高、易于实施的优点。本文分析了其与新辅助化疗结果之间的一致性。现作如下报告。
1 研究资料与研究方法
1.1 研究资料
本次研究选择 2020 年 6 月到 2022 年 5 月在我院进行治疗的乳腺癌新辅助化疗患者共 52 例。所有患者对本次研究知情且签署同意书。此次研究也经过医院伦理委员会批准并同意。
此次参与研究的患者最小年龄为32岁、最大年龄为72岁,平均年龄为( 47.89±10.79 )岁。所有患者的基本病情无明显差异,具有较强的可研究性。
在本次研究过程中,要按照以下标准选择研究对象:(1)利用空心针穿刺,经过活检确诊为原发性乳腺癌患者;(2)在患者化疗之前,肿瘤未出现远处转移;(3)无肿瘤病史、家族遗传病史和乳腺癌手术史的患者。
此外,为了保证研究的合理性,还要按照以下标准排除不适合参与研究的患者:(1)排除有心、肺等严重器质性疾病的患者;(2)排除对化疗治疗敏感的患者;(3)排除炎性乳腺癌患者;(4)排除有其他类型肿瘤或者精神类疾病的患者。
1.2 研究方法
在本次研究过程中,患者在新辅助化疗之前通过穿刺活检确定为乳腺癌。在我院开展 4~6 个周期的新辅助化疗,参与研究的患者主要完成 TAC 和 TA 方案,具体操作如下 :多西他赛、吡柔比星、环磷酰胺、多希塔赛的用量分别为 75mg/m2、50mg/m2、600mg/m2。在化疗过程的第一天使用,每三周进行一次,21 天为一个周期。在新辅助化疗后开展手术治疗。
3D-HDRA 检测操作。在开展 3D-HDRA 检测操作时,需要获取患者的肿瘤手术组织,并对样本进行穿刺,之后完成微小组织快培养,要确保与体内高度相关性的生长模式。在药物共培养过程中,需要对体内药物作用体系进行模拟,最后利用 MTT 与葡萄糖代谢等多终点快速检测获取结果。
1.3 观察指标
在本次研究过程中,主要从以下指标出发对 3D-HDRA 检测与乳腺癌新辅助化疗结果的一致性进行分析:
1.3.1 客观缓解率指标。对比分析 3D-HDRA 检测结果与乳腺癌临床新辅助化疗结果之间的客观缓解率。
1.3.2 与病理学的一致性指标。分别对比 3D-HDRA 检测结果与乳腺癌临床新辅助化疗结果与病理学之间的一致性,从而判断两者之间的一致性。
1.3.3 其他检测指标对比。分析 3D-HDRA 检测与临床新辅助化疗结果的敏感度、特异度、准确度、阳性预测值、阴性预测值。
1.4 统计学方法
在本次研究过程中,需要利用统计学软件 SPSS 19.0 完成数据统计和研究工作。在新辅助化疗后利用不同的评价方法判断其与病理评价的一致性时,需要通过Kappa 进行检验,其中 Kappa 在 0.75 以上说明具有良好的一致性;Kappa 在 0.4~0.75 之间说明一致性相对较好;Kappa 在0.4 以下说明一致性比较差。
2 研究结果
2.1 客观缓解率对比结果
为了明确两种结果之间的差异,需要对客观缓解率进行对。在本次研究过程中,3D-HDRA 检查的客观缓解率为 81% ,新辅助化疗结果在检查后的客观缓解率为 80.9% ,对不同的检测结果之间进行对比,其差异性比较小, P>0.05 。
2.1 与病理学的一致性对比
3D-HDRA 与病理学学的一致性达到 0.758;新辅助化疗结果与病理学的一致性达到 0.791 。两种结果的Kappa 值均在0.75 以上,都与病理学具有良好的一致性。
2.3 其他检测指标对比
3D-HDRA 检测与乳腺癌新辅助化疗的敏感度、特异度、准确度、阳性预测值、阴性预测值具体见表1。
表1 其他检测指标对比结果
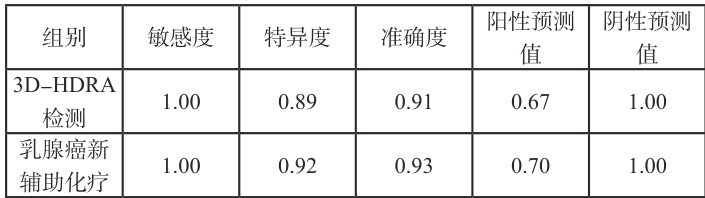
分别为1.00、0.89、0.91、067、1.00;而新辅助化疗手段敏感度、特异度、准确度、阳性预测值、阴性预测值分别为1.00、0.92、0.93、0.70、 1.00 两组之间的差异比较小,P>0.05
3 讨论
对于乳腺癌,新辅助化疗是临床上较为常用的疗法 [3]。近年来,相关研究结果表明采用该疗法后获取病理完全缓解的乳腺癌患者远期生存率有较大程度的改善;更为重要的是,其在降低肿瘤分期、保证保乳手术率等方面起着关键性作用 [4]。有学者认为,该方法可作为体内药敏试验对化疗敏感性等指标实施有效评价。一系列的研究结果显示,对于此种治疗方法,患者的化疗敏感性差异比较大;不敏感群体接受新辅助化疗往往会造成局部治疗时机被延误,出现明显毒副作用 [5]。故而,在临床实践中需对癌症病人的新辅助化疗敏感性进行评价,以便于制定科学的疗法。
随着分子生物学研究工作的深入发展,很多分子生物学指标在乳腺癌临床诊断预后化疗疗效预测方面都发挥着重要的作用。现阶段,在临床常规检查中的生物学因子包括PR、P53、ER 等 [6-7]。血管生成作为乳腺癌以及其他实验肿瘤生长转移的重要过程,与血管生成介质、血管内皮细胞生长因子的调控作用之间有密切的联系。乳腺癌发生和发展本身涉及的因素比较多,主要包含癌基因的激活和抑癌基因失活 [7]。在对抑癌基因进行研究时,如果是散发性、非家族性乳腺癌会参与多种信号传导途径。
在本次实验过程中主要分析 3D-HDRA 检测与新辅助化疗结果在乳腺癌患者化疗后诊断结果的一致性,明确生物学因子表达状态与新辅助化疗疗效之间的联系,从而更加准确地查找化疗前对乳腺癌新辅助化疗疗效有明显预测作用的生物学指标。这对开展临床用药指导有一定的现实意义。
3D-HDRA 检测主要是将手术切除或者活检获取的活性肿瘤组织块经过体外培养后,开展药物敏感性检测的方法。从本质上出发进行分析,3D-HDRA 检测是一种独特的体内样体外肿瘤活组织器官模型。该检测方法是与体内相关性比较高的体外肿瘤药品检测方法。在具体的操作过程中,需要将手术切除或者活检获取的活性肿瘤组织块经过体外培养,利用药敏感性进行检测。因为是肿瘤组织天然三维结构特征和三维生长方式,主要是以正常组织和恶性组织的分化结构的形成为主的 [8]。因此,可以对患者的预后进行科学预测和评价。此外,利用 3D-HDRA 检测方法还可以对肿瘤的外基质细胞之间的相互粘附作用、信息传导、肿瘤异质性和致瘤性等进行全面分析。这样可以体外肿瘤模型能够保持与体内肿瘤生物学一致。可以研究药物反应、细胞增殖、基因突变、细胞周期进展、抗原表达、抑制癌细胞迁移、清洗免应答等内容。构建与体内一致的体内样生长、体内样药物应答的独特的体内样肿瘤或组织器官模型。在对乳腺癌患者的具体病理情况进行判断时有积极的意义。
3D-HDRA 技术平台可以针对所有实体肿瘤中的不同样本开展体外培养、药敏检测、产品研发工作,为肿瘤患者提供生命全周期动态以及实时药物敏感性和耐药性检测、监测,从而实现个体化精准治疗 [9]。在实际操作过程中 3D-HDRA 包含微小组织块培养、药物敏感性检测、穿刺液 3D 培养药物敏感性检测、循环肿瘤细胞 3D 培养药物敏感性检测等。HDRA 在临床上的一致性比较好,技术也相对成熟。根据检测结果开展治疗,能够有效改善患者的预后,对延长患者的生存期有积极作用。
现阶段,在临床试验中已经证实了新辅助化疗后的病理完全缓解的激素受体阴性或者 HER2 阳性乳腺癌患者的无病生存期更长。而在本次研究过程中,3D-HDRA 检查的客观缓解率为 81% ,与病理学的一致性达到 0.758;新辅助化疗结果在检查后的客观缓解率为 80.9% ,与病理学的一致性达到 0.791 。两种结果均与病理学有良好的一致性。3D-HDRA 检查的敏感度、特异度、准确度、阳性预测值、阴性预测值分别为1.00、0.89、0.91、067、1.00;而新辅助化疗结果的相关指标为 1.00、0.92、0.93、0.70、1.00。两组之间的差异比较小, P>0.05 。
综上,3D-HDRA 检测结果与乳腺癌临床新辅助化疗结果的一致性相对良好。在乳腺癌患者的临床检测过程中3D-HDRA 可以发挥作用,具有良好的应用前景。
参考文献
[1] 林佳雯 , 卫姣飞 . 肿瘤浸润免疫细胞与乳腺癌新辅助化疗敏感性及预后关系的研究进展 [J]. 医学研究生学报 ,2022,35(4):437-442.
[2] 肖晶晶, 黄美玲, 延常姣, 等. Her-2 阳性乳腺癌新辅助化疗联合靶向治疗获得病理完全缓解的影响因素 [J]. 实用医学杂志 ,2022,38(5):542-546.
[3] 张玉 , 袁权 , 汤增辉 , 等 . ADC 值联合 18F-FDG PET/CT 最大标准摄取值对乳腺癌新辅助化疗疗效的预测价值 [J]. 放射学实践 ,2022,37(5):550-555.
[4] 黎东梅 , 王茹 , 任盟 , 等 . 基于 FMEA 模型的预防性护理在乳腺癌植入输液港化疗患者中的应用 [J]. 海南医学 ,2022,33(18):2445-2448.
[5] 崔杰 , 刘鑫 . 纤维蛋白原与白蛋白比值与激素受体阳性 / 人类表皮生长因子受体 2 阴性乳腺癌新辅助化疗疗效相关性分析 [J]. 陕西医学杂志 ,2022,51(11):1351-1354,1359.
[6] 王莉莉 , 刘龙秀 , 潘俊 , 等 . 循经冥想联合积极心理暗示对乳腺癌化疗患者心境及疲乏 - 睡眠障碍症状群的影响 [J]. 上海护理 ,2022,22(6):30-34.
[7] 代月宇 , 宋启斌 , 胡伟国 . 首诊Ⅳ期乳腺癌化疗后原发灶手术患者的特异性生存预后分析及列线图构建 [J]. 癌症 ,2020,39(8):382-390.
[8] 刘定燮 , 吴勇 . 间变性淋巴瘤激酶通路标签与乳腺癌细胞去分化、新辅助化疗反应及复发风险的相关性 [J]. 癌症 ,2020,39(11):496-508.
[9] 石志强 , 邱鹏飞 , 刘雁冰 , 等 . HER2 阳性和三阴性乳腺癌新辅助化疗后选择性避免腋窝手术分期的研究 [J]. 中国癌症杂志 ,2020,30(3):186-191.
[10] Orsaria P,Grasso A,Ippolito E,etal. Clinical outcomes among major breast cancer subtypes after neoadjuvant chemotherapy:Impact on breast cancer recurrence and survival[J].Anticancer Res,2021,41(5):2697-2709.
项目名称:3D-HDRA 检测结果与临床化疗效果的一致性的相关研究。
项目编号:2020NS134
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)