CD9 在淀粉样变性的预后评价研究

庄强 项丽娜 陈诚 江松福 冯建华
温州医科大学附属第一医院 温州 325000
中图分类号:文献标志码:A
文章编号:
开放科学(资源服务)标识码(OSID):
淀粉样变性(AL 型)是一种罕见的全身性疾病,其特征是一类多系统受累及的克隆性浆细胞及其分泌产物轻链发生错误折叠,沉积在器官组织导致疾病发生,可累及肾脏、心脏、肝脏、皮肤软组织、外周神经、肺、腺体等多种器官及组织[1]。由于淀粉样变性(AL 型)没有特异性的临床表现,使得一线医生早期难以及时确诊,且该类疾病一旦触发,进展非常迅速。清除淀粉样蛋白沉积物联合减少前体的产生能阻止和逆转淀粉样蛋白的积累并加速恢复器官功能,所以早期诊断和取得尽早深度缓解对于 AL 患者长期生存至关重要[2-4]。AL预后因素较多,该疾病的预测和早期诊断仍然是一个挑战。目前,通过流式细胞仪分析血液系统肿瘤骨髓标本的微小残留病灶(minimal residual disease, MRD)水平是公认的独立预后因素之一。通过流式细胞仪分析这些标本并寻找AL 相关的特异性指标及独立预后因素,有助于及时对AL 患者进行诊断和风险分级,从而指导个体化治疗。CD9 属于四聚交联体超家族成员之一,其是分子量为 24-27kDa 的细胞表面糖蛋白。CD9 分子广泛分布于血液和非血液系统来源的正常或肿瘤细胞,其通过与多种其他四聚交联体及其相关成分相互联系,CD9 参与多种细胞功能,例如细胞迁移、粘附、增殖和分化等[5,6]。研究发现 CD9 分子与多种肿瘤的进展、转移、复发和临床预后相关[7-10]。鉴于这些发现,CD9 或许有望成为AL 诊断和预后评价的特异性指标。
一、资料与方法
1.病例资料 本项回顾性研究涉及我院血液内科在 2021 年 5 月-2024 年 12 月新确诊的38 例初发淀粉样变性(AL 型)患者。其中男性患者22 例(57.9%),女性患者 16 例(42.1%)。年龄范围 37-85 岁,平均年龄 64Y 基础疾病方面,合并高血压患者 11 例(30.16%),合并糖尿病患者 6 例 (16.67% ),合并肾功能不全患者 13例(35.71%)。纳入标准:符合《AL 型淀粉样变性诊断和治疗指南(2021 年版)》中的确诊标准,即组织活检(脂肪或肾脏)发现刚果红染色阳性淀粉样物质(见图 1 图 2),且免疫组化或质谱分析证实为轻链型。患者及家属签署知情同意书,本研究经医院伦理委员会批准(伦理批号:2021 第 063 号)。骨髓标本所有患者均为治疗前骨髓。
图 1 腹壁脂肪组织刚果红染色阳性
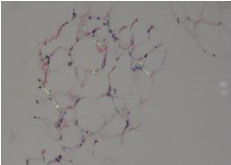
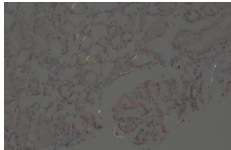
图 2 肾脏组织刚果红染色阳性
2.方法 直接荧光标记的单克隆抗体:CD9、CD38、CD138、CD56、CD117、CD81、轻链κ、轻链λ等,检测试剂盒为(MULTISCIENCES, Hangzhou, CN),流式细胞仪型号 Navios 美国 Beckman Coulter 公司。抽取患者治疗前骨髓 2-3ml 至EDTA 管中, 在流式管中加入抗凝骨髓 50μl 及 CD45 和直接荧光标记的单克隆抗体 5μl,混匀, 在 20 -25℃室温下避光反应20min,然后再加 2ml 红细胞裂解液,避光 10min.再用离心机于 1500r/min 离心 5min。弃上清,PBS1mL 洗涤。在 1d 以内上机检测。使用 Annexin V-APC/7-AAD 在流式细胞仪上进行检测。每管收集 2 万个细胞,采用CD45/SSC 双参数散点图设门,对原始细胞群进行分析,阳性判断标准:CD9 及相关抗原阳性细胞≥20%。收集我科于 2021 年 5 月-2024 年 12 月新确诊的淀粉样变性(AL 型)患者治疗前的CD9、年龄、性别、骨髓浆细胞比例、血红蛋白、肌酐、β2 微球蛋白、白蛋白、肌钙蛋白T、NT-proBNP 等临床指标检测结果。
3.统计学处理 采用 SPSS26.0 统计软件进行数据分析与图表绘制。符合正态分布的计量资料以 (σX±s) 表示,组间比较采用独立样本t 检验;不符合正态分布的计量资料以中位数(四分位数间距)[M(Q1,Q3)]表示,组间比较采用Mann-WhitneyU 检验;计数资料以[n(%)]表示,组间比较采用 χ2 ²检验。
二、结果
1.本次回顾性研究纳入了初诊淀粉样变性(AL 型)患者共 38 例,其中发现 CD9 阳性 20 例(图 3),CD9阴性 18 例(图 4)。
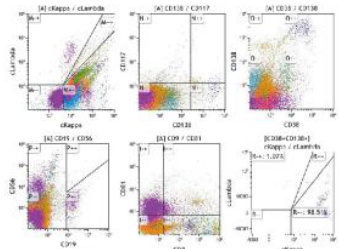
图 3 CD9 抗原表达阳性
图 4 CD9 抗原表达阴性
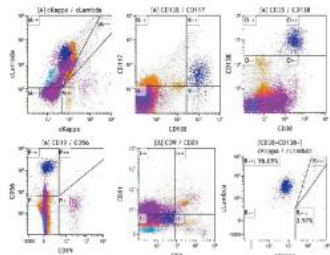
2.CD9 表达和多种临床指标存在明显关系。从表格数据能看到不同血检指标下 CD9 阴性、阳性表达率有差异。例如骨髓浆细胞比例高患者中,CD9 阴性表达率为 30%,阳性表达率是 70%;血红蛋白减少,CD9 阴性表
达率为 75%,阳性表达率达到 25%等情况(表 1)。这显示出 CD9 表达和临床指标之间存在内在联系,也许对疾病诊断和评估有重要价值。通过剖析这些关系可能更深入地认识淀粉样变性病理生理过程。表 1 CD9 表达和多种临床指标关系

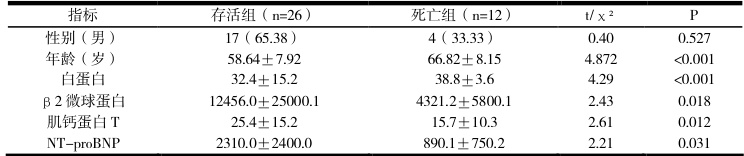
1.根据随访至少一年以上结局将患者分为存活组(26 例)与死亡组(12 例),两组患者基线临床及实验室指标比较见表 2。由表2 可知,死亡组患者年龄、β2 微球蛋白(ug/L)、肌钙蛋白T(ng/L)、NT-proBNP(ng/L)水平显著高于存活组,白蛋白(g/L)水平显著低于存活组,差异均具有统计学意义(P<0.05);两组患者性别患病率比较,差异无统计学意义(P>0.05)。
表 2 两组患者基线临床及实验室指标比较
三、讨论
淀粉样变性(AL 型)是一种复杂的疾病,其特征是淀粉样蛋白在多个器官中沉积,导致进行性功能障碍。早期诊断和干预对于改善患者的预后具有重要意义。多数患者的预后较差,且预后受多种因素影响,包括年龄、性别、细胞遗传学、分子生物学、个体健康状况及接受治疗的反应等情况影响。预后因素的不断细化,使得临床诊治更具针对性和个体化。近年来,随着分子生物学和免疫学的发展,越来越多的研究开始关注细胞表面分子在疾病发生发展中的作用。CD9 作为一种重要的细胞表面分子,其在淀粉样变性(AL 型)中的预测作用引起了广泛关注。CD9 是一种四次跨膜蛋白,广泛表达于多种细胞表面,包括免疫细胞、生殖细胞以及肿瘤细胞等。CD9 在细胞信号传导、细胞黏附以及细胞迁移等方面发挥重要作用。研究表明,CD9 的异常表达与多种疾病的发生发展密切相关。本回顾性研究淀粉样变性(AL 型)患者的临床指标,利用免疫组化、流式细胞术等技术手段,检测 CD9 在患者体内的表达情况。结果显示,淀粉样变性(AL 型)患者体内 CD9 的表达水平与各临床指标相比存在明显关系。进一步分析发现,CD9 的表达水平与疾病的严重程度和预后密切相关。
回顾分析初诊淀粉样变性(AL 型)患者的CD9 抗原表达水平、年龄、性别、骨髓浆细胞比例、血红蛋白、β2 微球蛋白、白蛋白、肌钙蛋白T、NT-proBNP 等临床指标,发现存在明显关系。其中骨髓浆细胞比例高、肌钙蛋白 T 高、NT-proBNP 高、肌酐高、血红蛋白低初诊淀粉样变性(AL 型)患者的 CD9 阴性表达率更高。为了更科学地剖析CD9 表达和血检结果关系,研究运用了一系列统计分析方法。用 SPSS 26.0 做统计分析时,计量资料用均数±标准差表示,组间比较采用独立样本t 检验,计数资料采用 x: ²检验。这些方法保障了研究结果准确可靠使我们能精准判断 CD9 表达和各血检指标之间相关性及意义。借助这些统计分析发现死亡组患者年龄、β2 微球蛋白 (ug/L) 、肌钙蛋白 T(ng/L)、NT-proBNP(ng/L)水平显著高于存活组,白蛋白(g/L)水平显著低于存活组,差异均具有统计学意义(P<0.05);两组患者性别患病率比较,差异无统计学意义(P>0.05)。由此发现,CD9 表达阴性患者病情严重程度更重、死亡率更高、疾病负担更大。
本回顾性研究重点关注 CD9 在淀粉样变性预后评价方面,经过分析各临床指标得出了一些有临床意义的结论。但也存在不足,因淀粉样变性(AL 型)本身疾病罕见,年发生率不高,就本回顾性研究规模而言,本研究样本量有限,或许不能涵盖淀粉样变性(AL 型)所有临床亚型与复杂状况。这或许会使研究结果难以精准反映不同患者群体真实情况。但鉴于以上研究发现 CD9 表达水平和患者预后状况存在着关联显著。但数据分析推测了CD9 低表达患者往往预后较差,这一发现为临床医生评估患者预后提供了新的重要指标。从临床意义来讲,CD9或许可当作潜在生物标志物用于淀粉样变性(AL 型)预后评价。这有助于医生更精准制定个性化治疗方案,也能为患者病情监测提供有力依据。比如在疾病治疗期间,监测 CD9 表达变化能让医生及时知晓治疗效果、判断疾病进展状况。往后要进一步深入探究 CD9 作用机制,以便更好应用于临床实践,为淀粉样变性患者治疗和管理提供更有效的策略。
参考文献:
1.Merlini G. AL amyloidosis: from molecular mechanisms to targeted therapies. Hematology Am Soc Hematol
Educ Program. 2017;2017:1-12. 2.Oliva L, Orfanelli U, Resnati M, et al. The amyloidogenic light chain is a stressor that sensitizes plasma
cells to proteasome inhibitor toxicity. Blood 2017;129(15):2132-2142. 3.Quarta CC, Gonzalez-Lopez E, Gilbertson JA, et al. Diagnostic sensitivity of abdominal fat aspiration in
cardiac amyloidosis. Eur Heart J 2017;38:1905. 4.Fernandez de Larrea, L. Verga, P. Morbini, et al. A practical approach to the diagnosis of systemic
amyloidoses. Blood 2015;125:2239-2244. 5.Hemler ME. Tetraspanin functions and associated microdomains. Nature reviews Molecular cell biology 2005 Oct;
6(10): 801-811. 6.Leung KT, Chan KY, Ng PC, Lau TK, Chiu WM, Tsang KS, Li CK, Kong CK, Li K. The tetraspanin CD9 regulates
migration, adhesion, and homing of human cord blood CD34+ hematopoietic stem and progenitor cells. Blood 2011 Feb 10;
117(6): 1840-1850. 7.Gandemer V, Aubry M, Roussel M, Rio AG, de Tayrac M, Vallee A, Mosser J, Ly-Sunnaram B, Galibert MD. CD9
expression can be used to predict childhood TEL/AML1-positive acute lymphoblastic leukemia: proposal for an accelerated
diagnostic flowchart. Leukemia research 2010 Apr; 34(4): 430-437. 8.Herr MJ, Longhurst CM, Baker B, Homayouni R, Speich HE, Kotha J, Jennings LK. Tetraspanin CD9 modulates
human lymphoma cellular proliferation via histone deacetylase activity. Biochemical and biophysical research
communications 2014 May 16; 447(4): 616-620. 9.Dong T, Liu Z, Zhao S, Hu C, Liu Y, Ma W, Zhang Q. The Expression of CD9 and PIK3CD is Associated with
Prognosis of Follicular Lymphoma. Journal of Cancer 2015; 6(12): 1222-1229. 10.Huan J, Gao Y, Xu J, Sheng W, Zhu W, Zhang S, Cao J, Ji J, Zhang L, Tian Y. Overexpression of CD9 correlates
with tumor stage and lymph node metastasis in esophageal squamous cell carcinoma. International journal of clinical and
experimental pathology 2015; 8(3): 3054-3061. 基金项目:市科研项目CD9 在淀粉样变性的预后评价研究(Y20210805)。
作者简介:庄强,主治医师,E-mail:zhuangqiang1982@163.com。
.jpg)
.jpg)
.jpg)
.jpg)