右美托咪定对耳穴贴压联合硬膜外阻滞下分娩镇痛者产时发热的影响

黄智华 许丽华 张峰
福建省南平市人民医院麻醉科福建南平 353000
产时发热是分娩过程中的常见并发症,定义为产妇体温升高≥38℃。研究表明,接受硬膜外分娩镇痛的产妇中有13%-33%会出现产时发热,而未接受硬膜外镇痛的产妇发热率仅为 2%-5%。[2][9]这种“硬膜外相关产时发热”(Epidural-RelatedMaternal Fever, ERMF)不仅增加产妇剖宫产率、器械助产率和抗生素使用率,还可能对新生儿造成一系列不良影响,包括降低 Apgar 评分、增加新生儿呼吸窘迫风险、导致胎儿心动过速,甚至可能损害胎儿神经系统发育。[2][8]ERMF 的发生机制尚未完全明确,目前主要有两种理论解释:“体温调节失衡”与“无菌性炎症反应”。在体温调节方面,硬膜外阻滞可阻断交感神经,抑制皮肤血管舒张和出汗,减少散热;同时,宫缩痛缓解导致过度通气减少,呼吸道散热降低,最终导致热量蓄积。[9]在炎症反应方面,硬膜外局麻药物(如罗哌卡因)可激活促炎细胞因子释放,研究证实 ERMF 产妇血清中 IL-6、TNF-α等炎症因子水平显著升高。[1][5]值得注意的是,正常分娩本身即伴随着一定程度的炎症激活,而硬膜外镇痛可能进一步放大了这一过程。[8]为降低ERMF 风险,多模式镇痛策略逐渐受到关注。耳穴贴压作为传统中医疗法,通过刺激特定耳穴(如子宫、神门、交感等)调节机体功能,研究证实其联合硬膜外阻滞可增强镇痛效果,减少麻醉药物用量。 然而,单纯耳穴贴压联合硬膜外阻滞对 ERMF 的预防效果仍不理想。右美托咪定作为一种高选择性α-2 肾上腺素能受体激动剂,具有镇静、镇痛、抗焦虑和抗交感神经兴奋作用。最新研究表明,静脉输注右美托咪定可降低硬膜外分娩镇痛产妇的体温升高幅度,减少炎症因子释放。[1][5]其作用机制可能与抑制 MAPK/ERK 信号通路,调节炎症小体激活有关。[6][10]
基于上述背景,本研究提出一种创新性的多模式镇痛方案:在耳穴贴压联合硬膜外阻滞基础上加用右美托咪定。我们假设右美托咪定可通过其抗炎和体温调节作用,进一步降低 ERMF 发生率。本研究通过观察三组不同镇痛方案(常规硬膜外阻滞、耳穴贴压+硬膜外阻滞、耳穴贴压+硬膜外阻滞+右美托咪定)下产妇的体温变化、炎症因子水平及母婴结局,评估该联合方案的临床效果和安全性,为优化分娩镇痛管理提供新思路。
1.资料与方法
1.1 一般资料 本研究为前瞻性随机对照试验 经医院伦理委员会批准,所有参与者均签署知情同意书。选取 2020 年1月至 2022 年1 月期间在我院分娩单胎头位足月 例,随机分为三组。对照组:(n=60):仅接受硬膜外阻滞分娩镇痛。联合组(n=60):接受耳穴贴压联合硬膜外阻滞分娩镇。右美组(n=60):在联合组基础上加用右美托咪定静脉泵注。纳入标准:① 20-35 岁初产妇;② 孕周37-42 周单胎头位; ③ ASA 分级 I-II 级; ④ 自愿接受分娩镇痛并签署同意书。
排除标准:① 椎管内麻醉禁忌;② 发热(T≥37.5℃)或产前感染; ③ 妊娠期高血压、糖尿病等妊娠合并症;④ 胎儿宫内窘迫;⑤ 长期使用镇静镇痛药物史; ⑥ 中转剖宫产。
2.2 干预方案
耳穴贴压干预(联合组和右美组):由专业中医师在产妇宫口开至 3 cm 时,选取双侧耳穴(子宫、神门、交感、内分泌)进行贴压。将王不留行籽贴于所选穴位,指导产妇在宫缩时自行按压,每穴按压 1-2 分钟,间隔 30 分钟重复,直至分娩结束。[3]
硬膜外阻滞方案(三组均采用):产妇宫口开至 3 cm 时,建立静脉通路,输注乳酸林格氏液 500 mL。取左侧卧位,于L2-3 间隙行硬膜外穿刺,置管 3 cm。给予试验剂量 1%利多卡因 3 mL,确认无全脊麻后,所有产妇均采用 0.1%罗哌卡因复合 0.4 μg/mL 舒芬太尼的混合液进行镇痛。首剂负荷量8-10 mL,背景输注速率6 mL/h,自控镇痛剂量5 mL,锁定时间 15分钟。[4][5]
右美托咪定应用(仅右美组):在硬膜外阻滞平面固定后,静脉泵注右美托咪定(负荷剂量 0.5 μg/μg ,输注时间>10分钟;维持剂量0.4 μg/kg/h,持续至宫口开全)。[5]
2.3 观察指标
1. 体温监测:采用红外鼓膜温度计测量产妇镇痛前(基线)、镇痛后 2h、4h、6h、宫口开全时及分娩后2h 的体温变化。时发热定义为鼓膜温度≥38℃。[1
2. 炎症因子检测:分别于镇痛前、宫口开全时采集产妇静脉血 5 mL。离心分离血清后,采用 ELISA 法检测IL-1β、IL-6和 TNF-α浓度。[1][5]
3. 镇痛与镇静效果评估:
- 疼痛程度:采用视觉模拟评分(VAS,0-10 分)评估镇痛前、镇痛后 30 min、2h、4h 及宫口开全时的疼痛程度- 镇静程度:采用Ramsay 镇静评分(1-6 分)评估同期镇静状态
- 爆发痛:记录VAS≥4 分需追加自控镇痛的次数[4]
4. 药物用量及产程时间:记录硬膜外局麻药总用量、第一产程活跃期及第二产程时间。
5. 母婴结局:
- 产妇相关:分娩方式、产后出血量(胎儿娩出后24h 内失血量)、尿潴留发生率- 新生儿相关:出生后 1 min、5 min Apgar 评分、脐动脉血 pH 值及乳酸值[5][7]
6. 不良反应:记录各组产妇低血压(MAP<65 mmHg)、心动过缓(HR<50 次/分)、呼吸抑制(RR<10 次/分或 SpO₂<93%)、恶心呕吐等发生情况。
2.4 统计学分析
采用 SPSS 25.0 软件进行数据分析。计量资料以均数±标准差(\`x±s\`)表示,组间比较采用单因素方差分析(ANOVA),重复测量数据采用重复测量方差分析;计数资料以率(%)表示,组间比较采用 X2 检验或 Fisher 精确检验。设定 P<0.05 为差异有统计学意义。
3 结果
3.1 三组产妇基线特征比较
三组产妇的年龄、BMI、孕周、宫颈扩张程度及基线体温等一般资料比较均无统计学差异(P>0.05),具有可比性。所有产妇均为初产妇,ASA 分级I-II 级,胎儿均为单胎头位。
表 2:三组产妇不同时间点体温变化比较 cx±s \`,℃)
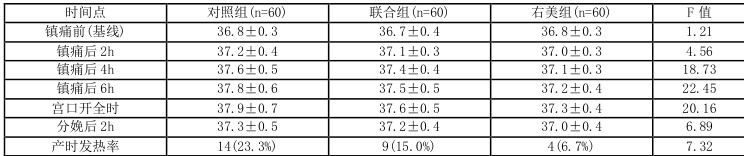
注:与对照组比较,P<0.05;与联合组比较,P<0.05
3.2 体温变化与产时发热率
三组产妇体温随时间延长均呈升高趋势,但右美组体温升高幅度最小。具体而言:- 镇痛后4h:右美组体温(37. 1±0.3∘C) )显著低于对照组(37. 6±0. .5℃, P⟨0. 001)和联合组(37.4±0.4℃,P=0.002)- 宫口开全时:右美组体温(37.3±0.4℃)显著低于对照组(37. 9±0 .7℃,P<0.001)和联合组(37.6±0.5℃,P=0.001)- 产时发热率:右美组(6.7%)显著低于对照组(23.3%,P=0.008)和联合组(15.0%,P=0.046)[1][5]3.3 炎症因子水平变化
镇痛前,三组血清 IL-1β、IL-6、TNF-α水平无显著差异(P>0.05)。宫口开全时,三组炎症因子水平均较镇痛前升高,但右美组升高幅度显著低于其他两组:
- L-6:右美组(45. 3±10.2pg/mL) )显著低于对照组(68. 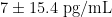 ,P<0.001)和联合组(58.6±12.8 g/mL,P<0.001)
,P<0.001)和联合组(58.6±12.8 g/mL,P<0.001)
-ΔTNF-a :右美组(18. 6±4.3pg/mL )显著低于对照组(26. 8±5.7pg/mL ,P<0.001)和联合组 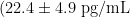 ,P=0.001)
,P=0.001)
- IL-1β:右美组(8.5±2.1 pg/mL)低于对照组(10.2±2.8 pg/mL,P=0.002),与联合组 (9.3±2.4pg/mL) )差异无统计学意义(P=0.087)[1][5][8]
表 3:三组产妇宫口开全时炎症因子水平比较(\`x±s\`,pg/mL
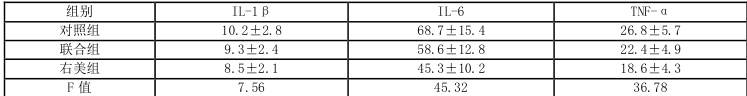
注:与对照组比较,P<0.05;与联合组比较,P<0.05
3.4 镇痛效果及药物用量
VAS 评分:三组产妇镇痛后各时间点 VAS 评分均较镇痛前显著降低 (P<0. .01)。右美组在镇痛后 4h(1.8±0.6)及宫口开全时(2.3±0.7)的 VAS 评分显著低于对照组(2.5±0.8,3.1±0.9)和联合组( (2.2±0.7 , 2.7±0.; 8)(P<0.05)。爆发痛发生率:右美组(8.3%)显著低于对照组(26.7%,P=0.006)和联合组(16.7%, P=0. 048) 。
硬膜外药物用量:右美组局麻药用量(45.2±8.7 mL)显著少于对照组(59.6±10.3 mL,P<0.001)和联合组(53.8±9.4 mL,P<0.001),较对照组减少约 24%,较联合组减少约 16%。[4][7]
Ramsay 镇静评分:右美组在镇痛后各时间点评分(2.8-3.2 分)均高于对照组(1.5-2.0 分)和联合组(1.8-2.3 分)(P<0.01),所有产妇评分均≤4 分,未出现过度镇静。
3.5 产程时间及母婴结局
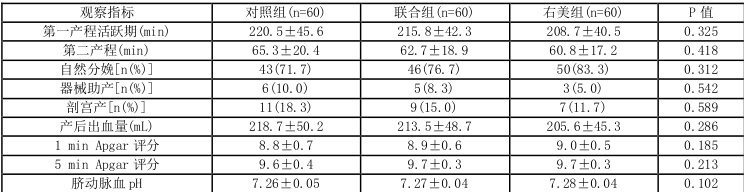
产程时间:三组第一产程活跃期及第二产程时间无显著差异(P>0.05)。
分娩方式:右美组自然分娩率(83.3%)高于对照组(71.7%)和联合组(
新生儿结局:三组新生儿出生体重、1 min 及5 min Apgar 评分、脐动脉血pH 值及乳酸值比较均无显著差异(P>0.05)。右美组无新生儿Apgar 评分≤7 分的情况,对照组有2 例(3.3%),联合组有1 例(1.7%),但组间差异无统计学意义(P>0.05)。[5][7]
产后出血量:右美组(205.6±45.3 L)与对照组(218.7±50.2 L)、联合组(213.5±48.7 L)无显著差异(P>0.05)。3.6 不良反应
右美组心动过缓发生率(6.7%)略高于对照组(1.7%)和联合组(0%),但差异无统计学意义 (P=0,052) 。所有出现心动过缓的产妇经减少右美托咪定输注速度后心率均恢复正常,无需停药。其他不良反应如低血压、呼吸抑制、恶心呕吐等三组间发生率无显著差异(P>0.05)。右美组尿潴留发生率(3.3%)显著低于对照组(13.3%,P=0.042)。[4][5]
表 4:三组产妇分娩及新生儿结局比较
4 讨论
4.1 右美托咪定降低产时发热的双重机制
本研究创新性地将右美托咪定应用于耳穴贴压联合硬膜外阻滞的分娩镇痛方案中,证实该药物可显著降低产时发热率(6. 7% vs 对照组23.3%)。这一效果主要归因于右美托咪定的抗炎作用与体温调节作用双重机制。
在抗炎机制方面,右美托咪定通过抑制 MAPK/ERK 信号通路,降低炎症小体活性,减少 IL-1β、IL-6、TNF-α等促炎因子的释放。[6][10]本研究结果显示,右美组产 IL-6 水平显著低于对照组和联合组,这与 Chen 等的研究结果致。[5]值得注意的是,IL-6 是产时发热的关键介质,其水平升高与体温上升幅度呈正相关。右美托咪定通过α2 受体介导的胆碱能抗炎通路,抑制核因子κB(NF-κB)活化,从而减少 IL-6 基因转录和蛋白合成。
在体温调节方面,右美托咪定作用于下丘脑体温调节 同时通过镇静作用减少肌肉活动和产热。本研究发现右美组产妇在镇痛后各时 口开全时差异最为显著。这一效果可能源于右美托咪定对交感神经张力的调节— 通过抑制去 阻滞导致 的血管收缩障碍,促进热量重新分布与散失。[9]
4.2 耳穴贴压的协同效应
本研究证实,单纯耳穴贴压联合硬膜外阻滞(联合组)虽能一定程度降低体温(产时发热率 15.0% vs 对照组 23.3%),但其效果不及联合右美托咪定方案(6.7%)。耳穴贴压可能通过神经内分泌调节发挥作用:刺激耳部"子宫"、"神门"等穴位可促进内源性阿片肽释放,增强镇痛效果,减少应激反应。 付滨等研究发现,耳穴压豆联合硬膜外阻滞可显著降低第二产程 VAS 评分及产妇心率,这与本研究结果一致。
然而,耳穴贴压对炎症反应的调节作用较弱。本研究中,联合组产妇 IL-6 水平虽低于对照组,但仍显著高于右美组。这表明右美托咪定与耳穴贴压可能存在协同作用:耳穴贴压通过调节自主神经功能增强右美托咪定的体温调节效果,而右美托咪定则通过强大的抗炎作用弥补了耳穴贴压在炎症调控方面的不足。
4.3 临床应用价值与安全性本研究中,右美托咪定展现出多方面的临床优势:
- 减少局麻药用量:右美组硬膜外药物用量较对照组减少24%,这与高永明的Meta 分析结果一致。 局麻药用量减少不仅降低运动阻滞风险,还可能直接减少 ERMF 发生——研究证实罗哌卡因可刺激线粒体活性氧产生,激活 NLRP3 炎症小体,促进 IL-1β释放。[8]
[4][7]这得益于右美托咪定的内源性镇痛机制——通过增强脊髓背角神经元超极化激活电流(Ih),抑制伤害性信号传导。
- 降低尿潴留风险:右美组尿潴留发生率(3.3%) 显著低于对照组(13.3%) ,这可能与其减少局麻药用量的效果相关。在安全性方面,右美组未增加新生儿窒息风 其他组相当),这与陈伟业的观点一致。[5]虽然右美组心动过缓发生率(6.7%)略高 组 速度即可控制,无需停药。值得注意的是,右美托咪定具有高胎盘蛋白结合率(约 94%),限制了其向胎儿的转运,这一特性保障了新生儿安全性。[4]
.4 研究局限性及未来方向
本研究的局限性包括:① 未检测右美托咪定对 MAPK/ERK 信号通路分子的直接影响; ② 缺乏不同剂量右美托咪定的比较(根据文献,0.4-0.5 μg/kg/h 为安全有效剂量[5][10]); ③ 未评估产妇长期随访结果及新生儿神经发育结局。
未来研究可深入探索以下方向:① 右美托咪定最佳剂量探索; ② 联合方案对产后抑郁的预防作用(利用右美托咪定的抗焦虑特性);③ 基于炎症因子水平的 ERMF 风险预测模型构建;④ 耳穴选择标准化及刺激参数优化。
5 结论与展望
本研究证实,在耳穴贴压联合硬膜外阻滞分娩镇痛方案中加用右美托咪定可显著降低产时发热发生率(从 15.0%-23.3%降至 6.7%),其机制主要涉及抑制促炎因子释放(特别是 IL-6)和调节体温中枢。此外,该方案还能减少局麻药用量 24%,降低爆发痛发生率,且不增加母婴风险。
建议临床推广以下多模式镇痛方案:对接受硬膜外分娩镇痛的产妇,在宫口开至3 cm 时实施耳穴贴压(取子宫、神门、交感、内分泌等穴),并于硬膜外负荷量给予后静脉泵注右美托咪定(负荷量 0.5 μg/kg,维持量0.4 μg/kg/h,至宫口开全)。应用过程中需监测产妇心率,警惕心动过缓发生。
未来研究应关注右美托咪定在特殊产科人群(如妊娠期高血压疾病、肥胖产妇)中的应用安全性,并探索其通过 MAPK/ERK信号通路调控炎症反应的具体分子机制。这一多模式镇痛方案有望成为预防硬膜外相关产时发热的优化策略,改善母婴分娩结局。
参考文献
[1] 陈伟业, 李宗存, 席四平, 等.静脉输注右美托咪定对硬膜外分娩镇痛相关产时发热的影响[J]. 河北医科大学学报, 2020, 41(12): 1444-1449
[2] in , hi , i B, t l.Association etween pidural nalgesia nd ndications or ntrapartum aesarean elivery: a retrospective cohort study[J]. BMC Pregnancy Childbirth, 2021, 21(1):
[3] Qian MJ, Gao F, Liu J, et al.Dexmedetomidine versus fentanyl as adjuvants to ropivacaine for epidural anaesthesia: a systematic review and meta-analysis[J]. Int J Clin Pract, 2021, 75(5):e13772.
[4] 陈旭林, 徐世琴.硬膜外相关产时发热可能机制及预防措施[J]. 现代妇产科进展, 2024, 33(3):232-236.
[5] rendt W, egal S.The ssociation etween pidural abor nalgesia nd aternal ever[J]. lin erinatol, 2013, 40(3):385-398.
[6] el rroyo G, anchez , atel , t l.Role f eucocyte aspase-1 ctivity n pidural-related ater fever[J]. Br J Anaesth, 2019, 122(1):92-102.
[9] 付滨, 刘燕, 张华.耳穴压豆联合硬膜外阻滞对分娩镇痛及应激反应的影响[J]. 上海针灸杂志, 2019,38(7):792-796.
[10] 美国妇产科医师学会(ACOG).产科镇痛和麻醉实践指南(2017)[S].
基金项目:南平市自然科学基金联合项目(2019J28)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)