白芍来源细胞外囊泡样颗粒的提取方法及活性评价

于海伦
亿航(苏州)生物医药有限公司 江苏苏州 215000
引言
细胞外囊泡(Extracellular Vesicles,EVs),是由细胞主动释放到胞外的脂质双层膜结构的微小囊泡的统称,可作为细胞间的媒介[1]。近年来,EVs 在生物医学领域研究中备受关注,尤其在疾病诊断[2]、治疗[3]和药物输送[4]方面的应用;而中草药(药用植物)EVs 更是成为新兴的热点领域[5],诸多研究表明其具有多种生物活性,包括抗炎[6]、抗氧化[7]、抗癌[8]等。在此背景下,本文结合实际项目对于白芍来源细胞外囊泡样颗粒(PRAEVLP)的提取方法及活性评价展开研究。
1 项目案例概述
本文研究案例为亿航生物与清华大学药学院开展的校企合作项目,共同研究中草药外泌体的天然功效,项目主要研究内容包括中草药外泌体提取工艺开发及功效评价方法、放大生产工艺开发、生物活性测试、细胞水平功效验证、建立实验室功效评价体系、体内动物试验及安全性评价等。
2 提取方法
PRAEVLP 超速离心提取方法:称取白芍饮片 50g ,漂洗干净,放入破壁机中,加入 500ml PBS浸泡过夜。第二天开启破壁机,先低速搅碎、再高速破壁得到白芍榨汁液。汁液通过300 目筛网过滤去除残渣,转入离心管中,4℃下差速离心,其步骤为 500g 、10min,2000g、20min,4000g、30min,10000g、60min。上清转入超离管中配平,使用超速离心机(贝克曼 XPN-100)配合水平转头(SW32Ti),设置离心力 110200g ,4℃离心 70min。用 1ml PBS 重悬沉淀,得到纯化的 PRAEVLP。按照《中草药细胞外囊泡研究与应用专家共识(2023)》[9]建议的质量控制,鉴定 PRAEVLP。
PRAEVLP 切向流超滤方法中的料液采用深层过滤膜包(科百特CDFCDCSD4047SP)进行澄清过滤,使用超纯水以流速 ⩽80mL/min 冲洗并排气,冲洗体积≥ 100L/m2 ;然后用 PBS,pH7.4 的平衡缓冲液以流速 ⩽80mL/min 平衡,平衡体积 ⩾50L/m2 ;平衡后进行料液澄清,流速 40mL/min,前端压力达到14.5psi 时更换膜包,直到料液澄清结束。
澄清料液使用中空纤维柱(截留孔径300kd,科百特 HFELAMO451030P)在切向流(英赛斯)设备上浓缩,设置参数见表 1;浓缩 10 倍后使用 0.2μm 滤器(科百特)过滤除菌,控制流速,前端压力达到14.5psi 时更换滤器,直到过滤结束。

3 PRAEVLP 生物活性评价
3.1 细胞毒性实验
此项实验所用细胞见表 2,复苏细胞后,待铺板率达到约 600 时,将其转移至 96 孔培养板中,并在恒温培养箱(Thermo,型号 150I)内,设定温度为 37qC 、 CO2 浓度为 5% 的条件下培养过夜。
实验设置包括空白对照组、溶剂对照组、阳性对照组以及实验组。实验组设 8 个浓度梯度,每梯度 3 个重复。细胞贴壁 40%~60% 时给药。溶剂对照加 DMEM,阳性对照加 10% DMSO,实验组加含样品的培养液。空白对照无细胞,仅加培养液。培养 24h 后,弃上清,加 0.5mg/mL MTT 试剂(Sigma),避光孵育 4h, 。孵育后,弃上清,加 DMSO,测 490nm OD 值,根据公式(1)计算:
细胞相对活力 (%) )=(样品孔OD−调零孔 OD)/(溶剂对照孔 OD−调零孔 OD∗100%
3.2 细胞增殖实验
将成纤维细胞悬液(5000 个细胞/孔)加入 96 孔板,  ,预培养 24h。加入 1~10μL 不同浓度的测试物质,继续培养 24h⨀ 。随后,每孔加入 10μL CCK-8 溶液(BMU106-CN,Abbkine),孵育 2h 。最后,用酶标仪在 450nm 处测量吸光度。
,预培养 24h。加入 1~10μL 不同浓度的测试物质,继续培养 24h⨀ 。随后,每孔加入 10μL CCK-8 溶液(BMU106-CN,Abbkine),孵育 2h 。最后,用酶标仪在 450nm 处测量吸光度。
3.3 美白功效评价
按参考文献[10]的方法测定黑色素含量。黑色素细胞复苏后,铺板至 60% 时,转移至 6 孔板,37℃、 5% CO2 培养过夜。细胞铺板 40%~60% 时,分组添加药物,每组 3 个重复。空白对照组加2mL 培养液,阳性对照组加 2mL 含光甘草定(上海奥利)的培养液,样品组加 2mL 含测试样品的培养液,继续培养 24h 。
24h 后,弃培养液,PBS 洗涤一次。用 0.25% 胰酶消化黑色素细胞(  ),37℃消化1~2 分钟,终止反应后收集细胞至 1.5mL 离心管,10000RPM 离心 10 分钟,弃上清。加入 200μL 蒸馏水, 500μL 无水乙醇和乙醚,混匀后室温静置 20 分钟,3000RPM 离心 5 分钟,弃上清。加入 ΔlmL 含 10% DMSO 的 1mol/L NaOH 水溶液, 80∘C 水浴加热 40 分钟。热孵育后,取 200μ L 上清液至 96 孔板,在 405nm 处测 OD 值,每个模型测两次。根据公式(2)计算:
),37℃消化1~2 分钟,终止反应后收集细胞至 1.5mL 离心管,10000RPM 离心 10 分钟,弃上清。加入 200μL 蒸馏水, 500μL 无水乙醇和乙醚,混匀后室温静置 20 分钟,3000RPM 离心 5 分钟,弃上清。加入 ΔlmL 含 10% DMSO 的 1mol/L NaOH 水溶液, 80∘C 水浴加热 40 分钟。热孵育后,取 200μ L 上清液至 96 孔板,在 405nm 处测 OD 值,每个模型测两次。根据公式(2)计算:
抑制率 (%) )=(空白对照组−样品组)/空白对照组 ×100%
使用 GraphPad Prism 作图,结果以 Mean±SD 表示。采用双尾 t-test 进行组间比较,判断标准见表 3。

巨噬细胞复苏后,铺板至 60% ,转移到 6 孔板, 37qC 、 5% CO2 培养过夜。弃旧培养液。空白对照组加 1.8mL 正常培养液,阴性对照组加 1.8mL 溶剂对照培养液,阳性对照组加 1.8mL 含 0.01%地塞米松(中检所)的培养液,样品组加 1.8mL 含测试样品的培养液。
给药后,继续 37% 、 5% CO2 培养 2h。各组每孔加入 200μL 含 1μg/mL LPS(Sigma)的工作液,再刺激培养 22h 孵育结束后,收集上清液,按照 IL-6 ELISA 试剂盒(Abcam)、TNF- ∝ ELISA 试剂盒(NOVUS)说明书进行ELISA 检测。根据公式(3)计算:
抑制率 (%) )=(阴性对照组−样品组)/阴性对照组 ×100% 图、结果表示、统计分析以及判断标准(表 3)与 3.3 章节中相同。
3.5 抗皱功效评价
成纤维细胞复苏后,铺板至 60% ,转移到  孔板, 37∘C 、 5% CO2 培养过夜。铺板 40%~60% 时,分组添加药物,每组 3 个重复。阳性对照组每孔加 2mL 含 TGF-
孔板, 37∘C 、 5% CO2 培养过夜。铺板 40%~60% 时,分组添加药物,每组 3 个重复。阳性对照组每孔加 2mL 含 TGF-  (Peprotech)的培养液,样品组每孔加 2mL 含测试样品的培养液,空白和阴性对照组加相同量的培养液。
(Peprotech)的培养液,样品组每孔加 2mL 含测试样品的培养液,空白和阴性对照组加相同量的培养液。
给药后,继续 37∘C 、 5% CO2 培养 24h。除空白对照组外,其余组别均进行 UVA 辐照,辐照剂量为 30J/cm2 ,辐照结束后,置于 37% 、 5% CO2 中继续培养 24h 孵育结束后,收集细胞培养上清液,按照 Collagen I ELISA 试剂盒(CUSABIO)说明书进行 ELISA 检测。根据公式(4)计算:
提升率 (%) )=(样品组−阴性对照组)/阴性对照组 ×100% 作图、结果表示、统计分析以及判断标准(表 3)与 3.3、3.4 章节中相同。
3.6 抗氧化功效评价
角质形成细胞复苏后,铺板至 60% ,转移到 6 孔板, 37∘C 、 5% CO2 培养过夜。铺板 40% ~60%时,分组添加药物,每组 3 个重复。阳性对照组每孔加 2mL 含 VE(中检院)的培养液,样品组每孔加 2mL 含测试样品的培养液,空白和阴性对照组加同等量培养液。
给药后,继续 37‰ 、 5% CO2 培养 24h 除空白对照组外,其余组别 UVB 辐照( 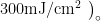 。辐照后,PBS 清洗 3 次,每孔加 1mL 10μM DCFH-DA 探针, 37∘C 、 5% CO2 培养 30 分钟。弃DCFH-DA,PBS 清洗 3 次,胰酶消化,PBS 清洗,加入 PBS 稀释,流式细胞仪检测。抑制率计算及统计方法同抗炎功效评价。
。辐照后,PBS 清洗 3 次,每孔加 1mL 10μM DCFH-DA 探针, 37∘C 、 5% CO2 培养 30 分钟。弃DCFH-DA,PBS 清洗 3 次,胰酶消化,PBS 清洗,加入 PBS 稀释,流式细胞仪检测。抑制率计算及统计方法同抗炎功效评价。
4 研究结果
本文研究策略如图 1 所示,一是采用金标准方法(超速离心法)提取 PRAEVLP,并多维度表征;二是评价 PRAEVLP 生物活性;三是采用切向流超滤方法和超速离心法分别提取 PRAEVLP,通过产量、稳定性、生物活性、成本等多方面对比两种方法的提取效果。
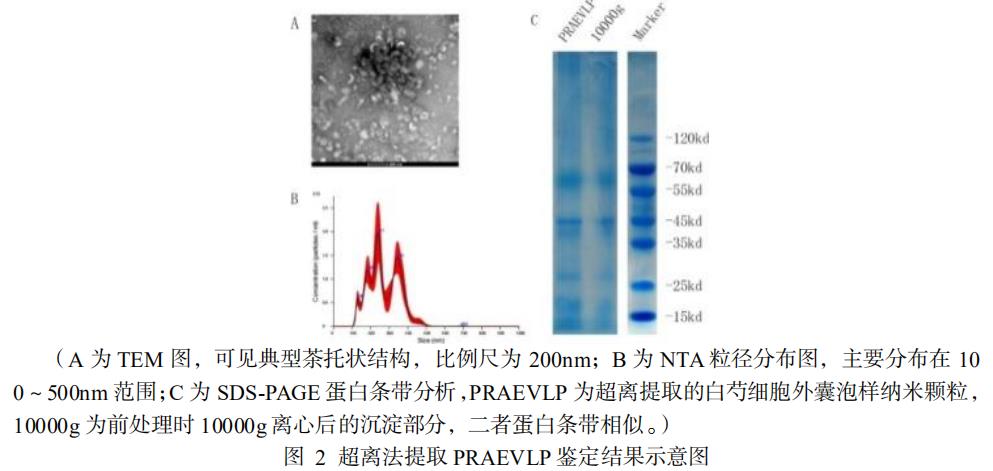
4.1 超速离心法提取 PRAEVLP 的鉴定结果
通过透射电子显微镜(TEM)对超离提取的 PRAEVLP 进行形态观察,可看到 PRAEVLP 直径分布 30~200nm 不等,为典型的茶托状形态,部分聚集呈粘连状态(图 2A)。通过 NTA 检测 PRAEVLP 的粒径分布范围在 30~500nm ,平均粒径 272.3nm ,峰值粒径 240.3nm ,粒子浓度 2.92e+12+/-2.81e+11particles/ml(图 2B)。通过 BCA 法测定 PRAEVLP 的蛋白浓度为 6.7mg/mL ,计算超离法提取的 PRAEVLP 蛋白颗粒比为 4.36e+11particles/mg。通过 SDS-PAGE 分析 PRAEVLP 蛋白条带主要出现在 60kd、45kd 及 25kd 处(图 2C)。
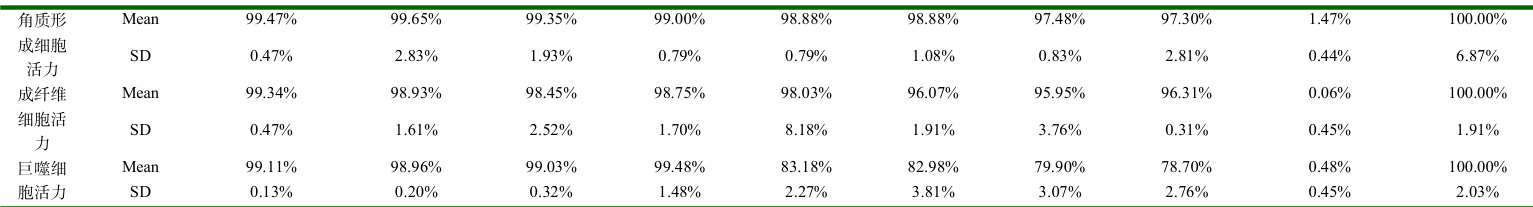
4.2 细胞毒性检测结果
对超离提取的 PRAEVLP 进行100 倍稀释,然后对倍稀释 7 个梯度,共计  个浓度梯度,分别在四种细胞上进行细胞毒性试验,为后续功效评价筛选安全浓度,结果详见表 4
个浓度梯度,分别在四种细胞上进行细胞毒性试验,为后续功效评价筛选安全浓度,结果详见表 4
PRAEVLP 在角质形成细胞和成纤维细胞中表现出低毒性,最大1%浓度细胞活力仍 >95% ;在黑色素细胞和巨噬细胞中表现出低毒性,细胞活力 >90% 的安全浓度分别为 0.125% 、 0.0625% 。

4.3 PRAEVLP 功效评价结果
4.3.1 细胞增殖
经过浓度梯度测试,PRAEVLP 在达到 20ug/mL 时,可显著促进成纤维细胞增殖( 138.5% , P<0 .01),且比对照组促增殖效果( 122.2% , P<0.01 )要好,二者同样有显著差异( P<0.05⋅ ),结果见图3F。
4.3.2 抗炎、美白、抗皱、抗氧化功效
抗炎效果:LPS 刺激后,NC 组 IL-6 和 TNF- ∝ 显著增加,确认刺激有效。PC 组(地塞米松)IL-6 和 TNF- ∝ 显著降低,证明阳性对照有效。PRAEVLP 组 IL-6 和 TNF-α显著下降,抑制率分别为 18.50% 和 65.21% ,P 值均 <0.001 (图 3A、图 3B),显示 PRAEVLP 具有抗炎作用。
美白效果:与 PC 组相比,PRAEVLP 组黑色素含量显著降低,抑制率为 10.19% , P<0.05 (图 3C),表明 PRAEVLP 具有美白效果。
抗皱效果:NC 组 Collagen I 含量显著下降,证明刺激条件有效。PC 组(TGF-β1)Collagen I 含量显著上升,阳性对照有效。PRAEVLP 组 Collagen I 含量显著上升,提升率为 333.09% ,P<0.001 (图 3D),显示 PRAEVLP 具有抗皱作用。
抗氧化效果:NC 组 ROS 含量显著上升,证明刺激条件有效。PC 组(VE)ROS 含量显著下降,阳性对照有效。PRAEVLP 组 ROS 含量显著下降,抑制率为 37.04% ,P 值 <0.001 (图 3E),表明 PRAEVLP 具有抗氧化作用。
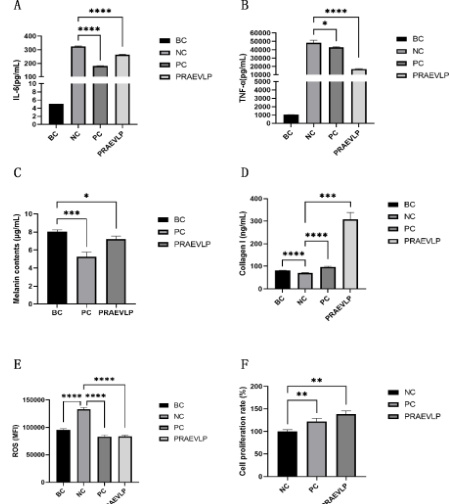
(A 为 IL-6 含量检测结果;B 为 TNF-α检测结果;C 为黑色素含量检测结果;D 为胶原蛋白 I 含量检测结果;E 为活性氧含量检测结果;F 为细胞增殖结果。)
4.3.3 切向流超滤法与超速离心法比较
使用切向流设备进行 PRAEVLP 多批次生产,与超离法进行对比,评估两种方法产量、稳定性、经济性,评价结果详见表 so
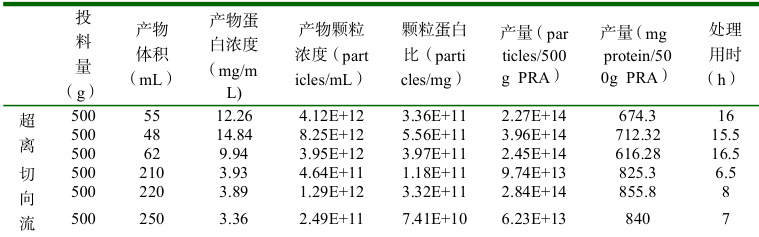
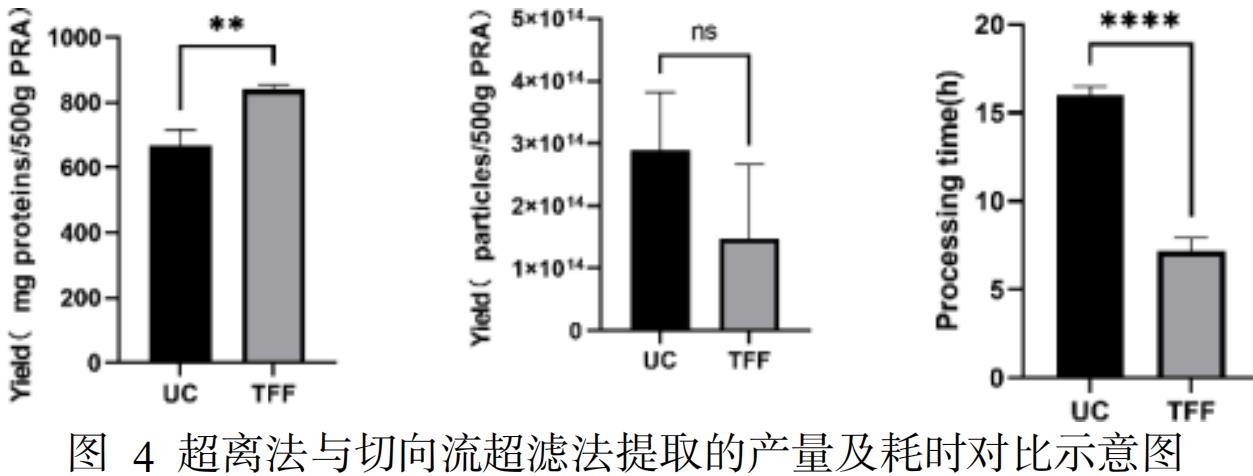
切向流超滤法的 PRAEVLP 颗粒产量与超离法相当,蛋白产量高于超滤法(有统计学差异 P<0.0
01),并且操作耗时显著少于超离法(见图 4),提高了经济性。
为了便于功效对比,选择 PRAEVLP 最具代表性的促增殖和促胶原蛋白 I 生成的功效进行对比评价(见图 5),以检验切向流超滤法和超离法提取的 PRAEVLP 是否有功效差异。结果显示,超离法和TFF 法提取的 PRAEVLP 均能显著促进成纤维细胞增殖和胶原蛋白 I 分泌,二者之间效果无显著差异。
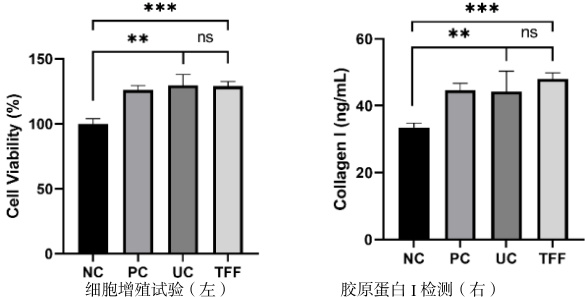
以上两项对比评估,认为切向流超滤法可替代超速离心法用于 PRAEVLP 的工业化生
5 结论
本文研究中成功提取了白芍来源的细胞外囊泡样颗粒(PRAEVLP),并对其活性进行评价。结果表明,PRAEVLP 具有良好的生物安全性,能够促进细胞增殖,在美白、抗炎、抗皱、抗氧化等方面具有显著功效,并在美容护肤和医疗领域均有应用潜力。通过切向流超滤方法可在保证生物活性的情况下,提高 PRAEVLP 产率,相较超速离心法具有突出优势;同时,本文也为进一步研究 PRAEVLP在其它方面的应用提供了参考依据。
参考文献:
[1] 王前,郑磊. 细胞外囊泡--基础研究与临床应用[M]. 北京: 科学出版社, 2019.
[2]KRISTINE R. JAKOBSEN, BIRGITTE S. PAULSEN, RIKKE B?K, et al. Exosomal proteins as potential diagnostic markers in advanced non-small cell lung carcinoma[J]. Journal of Extracellul ar Vesicles,2015,4(1).
[3] VIAUD S, THERY C, PLOIX. Dendritic cell-derived exosomes for cancer immunotherapy: what's next?[J]. Cancer research: The official organ of the American Association for Cancer Research, Inc,2010,70(4):1281-1285.
[4] 袁鹏,郭晓辰,张军平,等. 外泌体作为中药载体的研究进展[J]. 药学学报,2017,52(11):1667-167 2.
[5] Feng, Junjie,Xiu, Qi,Huang, Yiyao, et al.Plant-Derived Vesicle-Like Nanoparticles as Promisin g Biotherapeutic Tools: Present and Future[J].ADVANCED MATERIALS,2023,35(24).
[6] Ju, Songwen,Mu, Jingyao,Dokland, Terje, et al.Grape Exosome-like Nanoparticles Induce Inte stinal Stem Cells and Protect Mice From DSS-Induced Colitis[J].MOLECULAR THERAPY,2013,21(0 7):1345-1357.
[7] Zhang, Zeyu,Yu, Yang,Zhu, Guanxiong, et al.The Emerging Role of Plant-Derived ExosomesLike Nanoparticles in Immune Regulation and Periodontitis Treatment[J].FRONTIERS IN IMMUNOL OGY,2022,13.
[8] Boccia, Eleonora,Alfieri, Mariaevelina,Belvedere, Raffaella, et al.Plant hairy roots for the pro duction of extracellular vesicles with antitumor bioactivity[J].COMMUNICATIONS BIOLOGY,2022,5 (01).
[9] 中国研究型医院学会细胞外囊泡研究与应用专业委员会,中草药囊泡研究与应用专家委员会. 中草药囊泡研究与应用专家共识(2023 年版)[J]. 中草药, 2024, 55(1): 12-22.
[10] Lee, Ruri,Ko, Hae Ju,Kim, Kimin, et al.Anti-melanogenic effects of extracellular vesicles d erived from plant leaves and stems in mouse melanoma cells and human healthy skin[J].JOURNAL OF EXTRACELLULAR VESICLES,2020,9(01).
作者简介:于海伦,男,汉族,1984.07-,河北迁西人,本科,工程师,研究方向:生物医药、 外泌体研发
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)