优替德隆联合卡铂用于晚期三阴性乳腺癌的多中心、单臂Ⅱ期临床研究

陈文艳 兰琼玉 汪琛 陈凯旋
1 南昌市人民医院 南昌 330001 2 南昌大学第二附属医院 南昌 330006 3 赣州市人民医院 赣州 341000 4 赣州市肿瘤医院 赣州 341000
1. 引言
转移性乳腺癌(Metastatic Breast Cancer, MBC)预后差,其 5 年和 10 年生存率分别为 27%和 13% ,中位总生存期(OS)为 2-3 年 [1]。尽管紫杉类、蒽环类药物作为一线方案,耐药后治疗选择有限 [2]。优替德隆作为中国自主研发的新一代微管稳定剂,通过结合 β- 微管蛋白亚基抑制有丝分裂,其独特机制可克服紫杉类耐药 [3]。III 期 BG01-1324L 试验证实,优替德隆联合卡培他滨较单药卡培他滨显著延长 PFS(8.44 vs 4.27 个月,HR=0.46)[3],但联合其他化疗的真实世界证据仍缺乏。铂类是晚期三阴性乳腺癌的常用化疗药物,特别是对BRAC1/2 突变患者。本研究通过分析 23 例, 3 例,1 例, 1 例, 共28 例病例,探讨优替德隆联合卡铂的临床应用价值。
此外,微管抑制剂与其他化疗药物(如顺铂、卡铂)的协同作用可通过细胞周期多靶点干预机制实现,微管抑制剂通过稳定微管或抑制其解聚,阻断有丝分裂纺锤体的形成,导致细胞周期停滞于 G2/M 期,从而诱导凋亡。而铂类药物属于细胞周期非特异性药物,主要通过形成 Pt-DNA 加合物,干扰 DNA 复制与转录,引起 S期或 G1/S 期阻滞及 DNA 损伤反应。两者联合可覆盖不同细胞周期阶段,减少肿瘤细胞逃逸的可能性。铂类药物激活的 DNA 损伤反应(如 ATM/ATR 通路)与微管抑制剂诱导的 JNK/p38 应激通路存在交叉对话,协同促进促凋亡蛋白(如Bax、P53)表达,同时抑制抗凋亡信号(如Bcl-2)此外,铂类可能通过下调微管相关蛋白(如MAP4)增强微管抑制剂的稳定性。[5]
2. 研究方案
2.1 研究设计与入排标准
本研究为多中心、单臂II 期临床研究,经医院伦理委员会批准(批号:KY2021068)纳入标准:
签署知情同意书;
患者必须年满18 岁女性;
组织学或细胞学确诊的局部晚期或转移性TNBC
ECOG 体能评分(PS)0-2 分;
至少有一个可测量的病灶( 根据实体肿瘤疗效评价标准(RECIST1.1)评估 ) ;
排除标准:
HER-2 阳性( IHC+++ 或 FISH 阳性)或 ER/PgR 阳性;
过去 5 年内患有其他恶性肿瘤(包括原发性脑或软脑膜相关肿瘤),但是已治愈的皮肤基底细胞癌和宫颈原位癌除外;
既往晚期化疗阶段接受过埃博霉素类或铂类药物的治疗或接受埃博霉素类或铂类药物辅助 / 新辅助治疗后一年以内复发转移;
研究治疗开始前 4 周内进行过抗肿瘤治疗,包括化疗,根治性放疗,激素治疗,生物治疗、免疫治疗或抗肿瘤中药治疗;
符合入组标准的患者接受优替德隆联合卡铂方案治疗:
优替德隆:30mg/m2/ 天(IV),第1 到第 5 天,每天给药一次,21 天为一个治疗周
卡铂:AUC2,第 1 天、8 给药,21 天为一个治疗周期;
2.3 评价指标
主要终点:
客观缓解率 ORR :根据 RECIST 1.1 标准,从随机入组到疾病进展的过程中观察到的最佳疗效评价为 CR或 PR 的患 者人数占可评价患者总人数的比例。
次要终点:PFS,OS 及安全性
2.4 统计学分析
采用 SPSS 软件,生存分析采用 Kaplan-Meier 法。PFS 比较采用 Log-rank 检验。
3. 结果
3.1 基线特
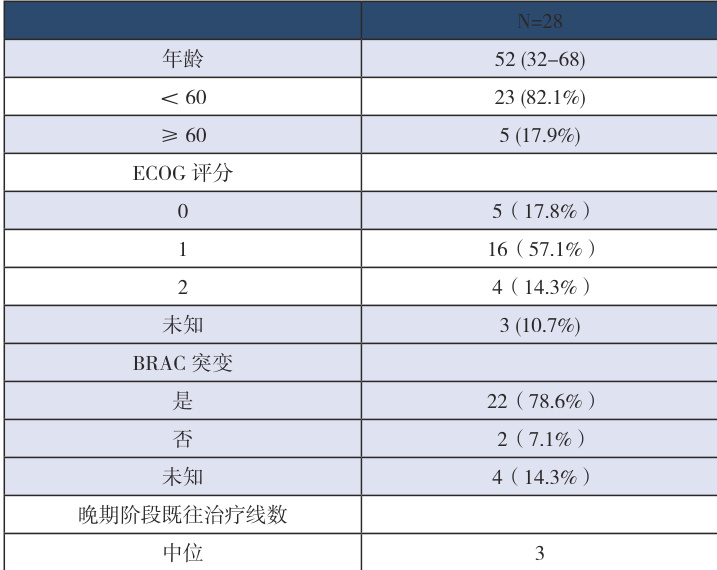
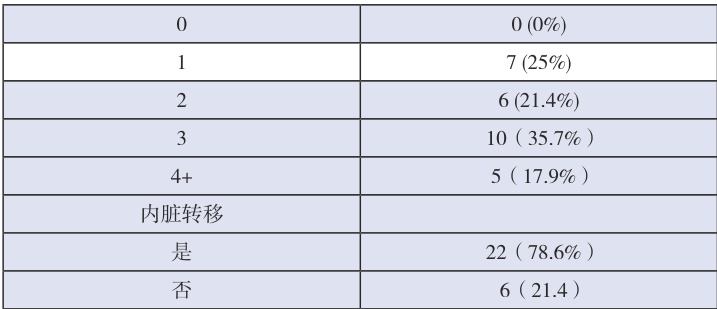
共纳入28 例患者,中位年龄52 岁(范围32-68)。既往中位治疗线数为3(范围 1-7)。见表1。
3.2 疗效分析
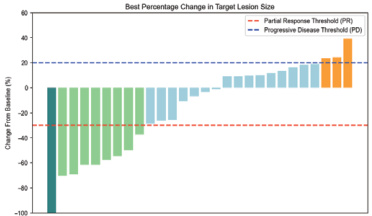
3.2.1 治疗反应率ORR 为 32.1% ,其中 1 例患者达到了CR,8 例患者达到了PR。DCR 为 89.5%0.0 详见图 1。图1 优替德隆 + 铂类治疗反应率
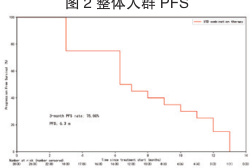
生存分析
总体中位 PFS 为 6.3 个月(95%CI: 4.3-9.0)
3.3 安全性
本研究 28 例患者中,所有患者均报告至少 1 项治疗相关不良事件 (ΔTRAE)⩾3 级 TRAEs 发生率为 35.7%(10/28),以周围神经病变(28.6%,8/28)为主,未发生治疗相关死亡事件。大多数不良反应通过剂量调整或支持治疗得到有效控制。
4. 讨论
本研究旨在评估优替德隆联合 阴性乳腺癌的疗效和安全性,探索优替德隆的联合作用机制及其临床价值,首次报道了优替 晚期 (TNBC)的临床实践结果。尽管样本量有限,但观察到整体 ORR 为 32.1% 、 92.9% , 且中位 PFS 为 6.2 个月,提示优替德隆联合卡铂在经治TNBC 患者中具有显著的后线治疗潜力,值得在更大样本中验证。
相较于 III 期 BG01-1324L 试验中优替德隆联合卡培他滨的 ORR( 40.4% )及中位 PFS(8.44 个月)[3],本研究的 ORR 与 PFS 略低,可能与人群差异有关:本研究纳入患者中位既往治疗线数为 3(范围 1-7),而BG01-1324L 试验仅限≤ 4 线治疗患者。此外,真实世界中更多患者存在内脏转移(本研究中占 71.4% vs 试验中的 63.2% ),可能导致治疗反应率下降。尽管如此,本研究的 DCR(92.9%)与 BG01-1324L 试验(90.1%)高度一致,进一步支持优替德隆在疾病控制方面的优势。
本研究中≥ 3 级周围神经病变发生率为 28.6% ,略低于 BG01-1324L 试验的 34.8%,可能与真实世界更灵活的剂量调整策略相关。
本研究存在以下局限:(1)样本量较小(n=28),可能掩盖潜在亚组差异;(2)缺乏标准化疗效评估间隔,可能影响PFS 计算的精确性。
5. 结论
优替德隆联合卡铂的II 期临床试验展现出可靠疗效与可控毒性,支持其作为晚期三阴性乳腺癌二线及以后的一种新的治疗选择,未来需要更多前瞻性研究进一步优化其联用策略和治疗方案。比如探索周疗或缩短输注时间以降低神经毒性,寻找预测疗效的分子标记(如微管蛋白亚型表达),以进一步提高疗效和安全性。
参考文献
【1】Cardoso F, Spence D, Mertz S, et al. Global analysis of advanced/ metastatic breast cancer: decade report (2005-2015). Breast. 2018;39: 131-138.
【2】Zhang P, et al. Utidelone inhibits breast cancer growth and metastasis through targeting β-tubulin. Cancer Res. 2020;80(16 Suppl):Abstract nr 1234.
【3】Xu B, et al. Utidelone plus capecitabine versus capecitabine alone for heavily pretreated metastatic breast cancer: a phase III trial. J Clin Oncol. 2021;39(15_suppl):1002.
【4】Mitchison TJ.The proliferation rate paradox in antimitotic chemotherapy.Molecular Biology of the Cell. 2012;23(1):1-6.
【5】Slamon DJ, et al. N Engl J Med. 2020;382(7):597-609.
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)