未成熟硬脑膜来源外泌体水凝胶在幼鼠颅骨损伤修复中的应用及机制研究

丁心怡 赵志军(通讯作者)
内蒙古科技大学包头医学院第一附属医院 内蒙古包头 014010
幼蛋鼠白摘颅表要骨达损:显目伤著的模增 型加本,研并透究采射旨用电在外子探泌显讨体微未水镜成凝下熟胶观硬治察脑疗到膜,典来使型源用外的泌H外E体 泌染结体色构水评。凝估动胶颅物在骨模幼修型鼠复中颅的,骨组外损织泌伤学体修特水复征凝中。胶的通治疗过疗效组W及e骨s其te组r机n织 制b再l。ot生 方和速法q度 R本较T-研对PC究照R 通组分过更析免快成疫,骨荧颅因光骨子检结R测构U波N恢X形复2蛋更、O白完P(整N V。i和m进eOn一CtiNn步 )的分,表析确达发认,现培进,养一治的步疗原探组代讨中细外成胞泌骨为体因未水子成凝R熟U胶N硬在X脑2颅膜、骨O细修P胞N复 。和中利O的用C分NW 子e的s机t蛋er制n白 。b及lo结t m果和R N透本A射 实表电验达子成水显功平微从显镜未著(成升T熟E高M (P<0.05) )体胞。的中结来提论源 取未和出成结外熟构泌硬特体脑征中膜。C来构D6建源3
Abstract: [Objective] This study aims to investigate the therapeutic efficacy and mechanisms of immature dura mater-derived exosome hydrogel in repairing cranial injuries in juvenile rats. [Methods] In this study, vimentin was detected through immunofluorescence to confirm that the cultured primary cells were indeed immature dura mater cells. Western blotting and transmission electron microscopy (TEM) were employed to characterize the source and structural features of the exosomes. A cranial injury model was established in juvenile rats, and the exosome hydrogel was utilized for treatment. Hematoxylin and eosin (HE) staining was conducted to evaluate the histological characteristics of cranial repair. The expression of osteogenic factors RUNX2, OPN, and OCN was analyzed using Western blotting and quantitative reverse transcription PCR (qRT-PCR) to further elucidate the molecular mechanisms by which exosome hydrogel facilitates cranial repair.[Results] The results indicated successful extraction of exosomes from primary immature dura mater cells, evidenced by a significant increase in CD63 protein expression, with typical exosome structures observed under transmission electron microscopy. In the animal model, the exosome hydrogel treatment group demonstrated accelerated bone tissue regeneration and more complete restoration of cranial structure compared to the control group. Further analysis revealed that the protein and mRNA expression levels of osteogenic factors RUNX2, OPN, and OCN were significantly elevated in the treatment group 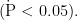 [Conclusion] The hydrogel derived from immature dura mater exosomes significantly promotes the repair of cranial bone injuries in young mice by enhancing the expression of osteogenesis-related factors, thereby providing new insights and potential therapeutic avenues for the clinical treatment of cranial bone injuries.
[Conclusion] The hydrogel derived from immature dura mater exosomes significantly promotes the repair of cranial bone injuries in young mice by enhancing the expression of osteogenesis-related factors, thereby providing new insights and potential therapeutic avenues for the clinical treatment of cranial bone injuries.
颅骨缺损对患者的生活质量造成严重影响,常见病因包括颅骨感染、严重的颅颌面创伤、先天性颅面畸形,以及神经外科或颌面外科手术后的并发症[1]。若不及时进行修复,颅骨缺损可能引发颅骨缺损综合征,甚至诱发脑组织损伤,严重威胁患者生命安全,同时还可能导致心理疾病和社交功能障碍等问题。值得关注的是,儿童头部意外损伤位于各种意外损伤之首,且近半数病例发生于3 岁以下的婴幼儿[2]。
颅骨成形术是一种通过自体骨或人工假体对颅骨缺损区域进行修复或重建的外科手术。该手术不仅能够恢复颅骨的结构完整性和外观形态,还可在一定程度上改善患者的神经功能[3]。然而,对于儿童颅骨成形术而言,手术时机的选择长期存在广泛争议。若选择早期修补,术后可能面临感染、材料破损、周围正常骨吸收,以及因颅骨材料限制周围骨组织生长而引发骨畸形,甚至出现颅脑损伤等风险;而若推迟至患儿生长发育到一定年龄再进行修复,则在此期间大脑长期处于缺乏颅骨保护的状态,可能导致脑萎缩、神经功能障碍等严重后果[4]。因此,儿童颅骨缺损的修复问题被认为是神经外科领域亟待突破的世界性难题,迫切需要安全、有效的临床解决方案。
硬脑膜(Dura Mater, DM)是脑膜中最外层的结构,不仅为脑实质提供坚固的物理屏障,还在脑脊液的更新与代谢中发挥着关键调控作用[5]。近年来,随着功能性淋巴管和大量免疫细胞在硬脑膜中的发现,研究逐步揭示其在免疫防御、免疫监测及体内稳态维持中的重要作用[6]。此外,有研究指出,硬脑膜在颅骨的生长与发育过程中亦具有关键调节功能[7]。来源于硬脑膜的外泌体(Exosomes,Exo)不仅可携带多种免疫相关分子,参与调节局部及远端的免疫环境,还富含多种生长因子和营养因子,具备促进组织再生与损伤修复的潜在生物学价值。Laurent Jacob[8]等人的研究表明,硬脑膜的背侧和尾侧区域分布有脑膜淋巴管,这些淋巴结构在脑组织废物的清除和免疫监视过程中发挥着重要作用。Fangning Zhao[9]等人的研究表明,硬脑膜分泌的外泌体能够促进颅骨细胞的增殖,颅骨再生依赖于成骨细胞、骨膜细胞和硬脑膜细胞之间的动态平衡。
本研究通过在出生后2 周的 SD 大鼠顶骨部位制备 5 mm 骨缺损,建立幼鼠颅骨缺损模型。随后,植入未成熟脑硬膜来源的外泌体水凝胶进行治疗,并通过组织切片 HE 染色观察颅骨恢复情况。此外,利用 Western blot 实验和qRT-PCR 检测了成骨相关因子的表达。该实验旨在探讨脑硬膜来源外泌体在儿童颅骨缺损治疗中的潜在作用,并为该领域提供新的实验方法和理论依据。
1 材料与方法
1.1 材料与试剂
DAPI(北京 Solarbio 公司);BCA 蛋白浓度测定试剂盒(北京 Solarbio 公司);PBS 缓冲液;RNase-Free 水;Triton-X100(生工生物工程(上海)股份有限公司);Trizol up(北京 Solarbio 公司);电转液(北京 Solarbio 公司);山羊血清(武汉 Boster 生物有限公司);GoTaq®1-Step RT-qPCR System(美国 Promage)。
超速离心机(美国 Thermo 生物公司);倒置共聚焦显微镜(日本 Nikon 有限公司);恒温培养箱(美国 Thermo 生物公司);PCR 仪(美国 Thermo 生物公司);恒温烘箱(美国 Thermo 生物公司);万分之一电子天平(美国 Thermo 生物公司);微型手持式颅骨钻(深圳市瑞沃德生命科技股份有限公司)。
1.3 试验方法
1.3.1 动物及分组
本研究使用了20 只 6-8 周龄的 SD 大鼠,实验动物购自北京斯贝福生物技术有限公司。经过一周的适应性喂养后,按 1:1 的比例合笼确认母鼠妊娠后将其单独饲养。幼鼠在出生后第 2 周随机分为对照组和外泌体水凝胶治疗组,并进行后续实验。所有动物均饲养在标准化动物房内,环境条件设定为恒温24℃,并保持12 小时昼夜循环。
1.3.2 未成熟硬脑膜原代细胞培
在处死1-3 日龄 SD 大鼠后,收集未成熟的硬脑膜组织,并用预冷的10%双抗-PBS 进行清洗。随后,将组织剪碎并在100 r/min 的速度下离心以去除血液残留,加入适量的一型胶原蛋白酶。将样品置于37℃水浴中加热20 分钟后,使用1200 r/min 离心,弃去上清液。最后,使用含有 15%胎牛血清的完全培养基重悬细胞和组织,并将其接种到培养瓶中,在37℃恒温恒压培养箱中进行培养。
1.3.3 外泌体提取
当未成熟硬脑膜原代细胞生长至约 70%汇合度时,更换培养基以进行外泌体收集。48 小时后,收集培养基并进行离心处理。首先,使
用 0.22 μm 滤芯过滤培养基,然后将其转移至超速离心管中,进行110,000 g 的超速离心1 小时。弃去上清液后,使用预冷的 PBS 重悬外泌
体,并将其存储于-80℃冰箱中。134免疫荧光
当未成熟硬脑膜原代细胞生长至约70%汇合度时,使用 4%多聚甲醛进行固定。固定后,使用 PBS 缓冲液洗涤以去除固定剂,再用0.1%的 Triton X-100 处理 10 分钟。接着,用3%的山羊血清进行封闭,孵育 30 分钟。随后,加入一抗,并在 4℃下孵育2 小时;接着加入荧光标记的二抗,孵育15 分钟。孵育结束后,进行洗涤,并在荧光显微镜下观察结果。
1.3.5 水凝胶制备
将水凝胶基质溶解于缓冲液或培养基中,制备均一的前体溶液,并调整其浓度和pH 值。将外泌体悬液缓慢滴加至前体溶液中,通过温和搅拌或低速涡旋确保均匀混合,避免剧烈操作导致外泌体损伤。将混合液注入预处理过的模具或培养皿中,并在恒温恒湿条件下进行固化。固化完成后,使用缓冲液或培养基清洗水凝胶,外泌体凝胶浓度为 15μg/ml,将负载外泌体的水凝胶储存于 4℃或其他适宜的环境中,供后续实验使用。
1.3.6 幼鼠颅骨缺损模型建立
选取对照组和外泌体水凝胶治疗组各 10 只2 周龄幼鼠。注射麻醉后,将实验动物俯卧固定于手术台,并使用碘伏进行消毒。沿颅骨矢状线作纵行切口,切口约1 cm,钝性分离头皮和颅骨,充分暴露矢状缝、双侧顶骨以及部分额骨和枕骨。使用高速牙科钻在顶骨部位制备5 mm 骨缺损。对于外泌体水凝胶治疗组,在缺损区植入外泌体水凝胶复合材料,而对照组不进行处理。手术切口缝合后,待动物苏醒并恢复后送回动物房,密切观察其生命体征和活动情况。
1.3.7 组织切片 HE 染色
取大鼠颅骨标本后,去除残留的软组织。使用 4%多聚甲醛溶液在 4℃条件下固定24 小时,随后更换为脱钙液,进行14 至21 天的脱钙处理。组织依次通过 50%、70%、85%、95%及 100%乙醇进行梯度脱水。接着,使用 50%二甲苯混合液处理 1 小时,再用纯二甲苯透明 4小时。组织经 60℃石蜡浸渍3 次后进行包埋,并在-20℃下快速冷冻10 分钟。修整蜡块后,制备5 μm 厚度的切片。脱蜡后,使用苏木精染色 10 分钟,盐酸乙醇分化3 秒,伊红复染 30 秒。最后,经脱水和透明处理后,用中性树脂封固保存,并在光学显微镜下拍照。
在幼鼠术后 2、4、6 周,处死动物后,从枕骨大孔开始,沿耳前缘和眶上缘完整剪取颅骨。仔细去除附着的肌肉组织,使用生理盐水冲洗3 次,剪碎后进行过夜裂解。离心后收集上清液并测定蛋白浓度。取一定量的蛋白样品,加入 loading buff,煮沸5 分钟进行变性处理。随后,将样品通过凝胶电泳分离90 分钟,电压设置为120-150V。将分离的蛋白转移到膜上,转膜2 小时,电压设定为 100V。使用 5%脱脂奶粉封闭膜30 分钟后,加入一抗,4℃孵育过夜。第二天,洗涤膜3 次,每次10 分钟,加入二抗,在室温下孵育1 小时。再次洗涤3 次后,进行显色,通过化学发光成像系统观察目标蛋白的条带,并分析目标蛋白的表达情况。
1.3.9 qRT-PCR
取幼鼠术后2、4、6 周的颅骨样本,并迅速将其放入液氮中冷冻。随后,使用 Trizol up 提取试剂盒提取总 RNA,并测定其浓度。利用反转录试剂盒对提取的总RNA 进行反转录,接着使用qRT-PCR 试剂盒进行基因扩增。扩增条件设定为:95℃变性2 分钟,随后进行40 个循环的扩增过程(95℃变性 10 秒,60℃退火 30 秒,72℃延伸 30 秒)。实验结束后,采用相对定量法(如 2^-ΔΔCt 法)计算目标基因的相对表达量。
实验数据采用 GraphPad Prism 9 进行统计学分析,结果以(x ±S)形式呈现。两组间的比较使用独立样本t 检验,Western Blot 及免疫荧光检测结果则使用 Image J 软件进行定量分析。统计显著性水平设定为 P <0.05。
2.1 原代未成熟硬脑膜细胞培养
为了确认培养的原代细胞是否为未成熟硬脑膜细胞,该研究对波形蛋白(Vimentin)进行了免疫荧光检测。结果显示,波形蛋白在所提细胞中得到了充分表达,表明这些细胞为原代未成熟硬脑膜细胞。Vimentin
图 1 原代未成熟硬脑膜细胞免疫荧光检测鉴定
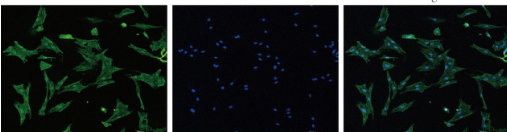
2.2 外泌体分离
为验证是否成功提取了未成熟硬脑膜来源的外泌体,我们采用CD63 蛋白的 Western blot 检测以及透射电子显微镜(TEM)观察进行分析。Western blot 结果显示,CD63 蛋白表达显著增加(P <0.05),同时在透射电子显微镜下可清晰观察到典型外泌体结构(红色箭头所示),证实外泌体的成功分离。
图 2 未成熟硬脑膜来源细胞外泌体鉴定
(A)CD63 检测结果;(B)透射电镜观察结果2.2 未成熟硬脑膜来源的外泌体水凝胶促进幼鼠颅骨损伤修复
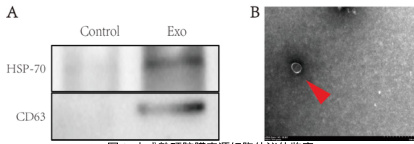
为评估未成熟硬脑膜来源的外泌体水凝胶在治疗颅骨损伤中的潜在疗效,该实验对对照组与外泌体水凝胶治疗组幼鼠在术后第 2、4、6周的颅骨组织进行了 HE 染色,并观察其修复情况。结果显示,外泌体水凝胶治疗组的颅骨修复程度明显优于对照组,表现为更快的骨组织再生及更完整的结构恢复。上述结果表明,未成熟硬脑膜来源的外泌体水凝胶对幼鼠颅骨损伤具有显著的治疗促进作用。
图 3 幼鼠颅骨组织 HE 染色(放大倍数:10×10)
2.3 未成熟硬脑膜来源的外泌体水凝胶促进成骨生长发育
为验证未成熟硬脑膜来源的外泌体水凝胶是否通过上调成骨相关因子促进幼鼠颅骨损伤的修复,本研究对成骨标志蛋白 RUNX2、OPN和 OCN 进行了 Western blot 分析,同时采用 qRT-PCR 检测相应基因的表达水平。结果显示,与对照组相比,外泌体水凝胶治疗组中RUNX2、OPN 和 OCN 的蛋白及 mRNA 表达均显著升高。上述结果表明,未成熟硬脑膜来源的外泌体水凝胶可能通过增强成骨相关因子的表达,促进颅骨缺损区域的骨组织再生,从而实现对幼鼠颅骨损伤的早期修复。
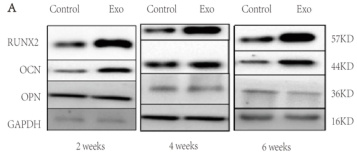
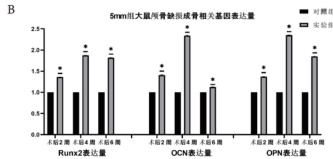
图 4 成骨相关因子检测注:*为与对照组相比 P<0.05 Western blot 检测 RUNX2、OPN 和 OCN;(B)qRT-PCR 检测 RUNX2、OPN 和 OCN
讨论
近年来,小儿颅骨缺损的发生率呈逐年上升趋势,其中以颅脑外伤所致者最为常见。此外,产伤、肿瘤及外科手术等亦是导致小儿颅骨缺损的重要原因[10]。在临床实践中,小儿颅骨缺损的修复不但需要恢复颅骨对神经系统的保护作用,更需要考虑到小儿颅骨在生长发育过程中的变化,不同修补时机以及所选择的修补材料常常会对最终的修复效果产生显著影响。在前期的研究也发现,未成熟硬脑膜在颅骨的发育过程中以及在颅骨缺损后的骨再生过程中发挥着关键作用[11]。
本研究通过培养原代未成熟硬脑膜细胞,并从中提取其来源的外泌体。免疫荧光检测结果显示,所培养细胞中波形蛋白表达充足,验证了其为未成熟硬脑膜细胞。进一步通过 Western blot 分析发现,外泌体标志蛋白 CD63 表达显著增加,且在透射电子显微镜(TEM)下可清晰观察到典型的外泌体结构。上述结果表明,本研究成功从未成熟硬脑膜细胞中提取得到了来源明确的外泌体。Argouarch AR[12]研究表明,未成熟硬脑膜细胞中波形蛋白高度表达,因此对波形蛋白进行免疫荧光染色可作为识别其细胞身份的重要标志手段。Panwar D[13]研究表明,CD63 可作为外泌体的经典标志蛋白,在外泌体中不仅被特异性标记,而且高度富集。上述结果均与本实验结果相一致。
基于上述实验结果,本研究构建了基于未成熟硬脑膜来源外泌体的水凝胶治疗模型,并通过颅骨组织 HE 染色评估其在术后第2、4、6周对颅骨再生的影响。结果显示,外泌体水凝胶治疗组在骨组织的再生速度及结构完整性方面均显著优于对照组,表现出更快的修复进程和更完善的组织重建。上述结果表明,未成熟硬脑膜来源的外泌体水凝胶在促进幼鼠颅骨缺损修复方面具有显著的治疗效应。Frassanito P[14]等人的研究也指出,未成熟硬脑膜在颅骨发育及缺损后骨再生中发挥重要作用,且在儿童颅骨修复过程中具有关键的生物学功能,合理选择修复材料可有效促进颅骨的正常生长与发育。其研究结论与本研究结果相一致。
为进一步探究未成熟硬脑膜来源外泌体水凝胶在治疗幼鼠颅骨缺损中的作用机制,本研究对术后第 2、4、6 周的幼鼠颅骨组织进行了成骨相关因子的 Western blot 及 qRT-PCR 分析。结果显示,与对照组相比,外泌体水凝胶治疗组中 RUNX2、OPN 及 OCN 的蛋白及 mRNA表达水平均显著升高。上述结果表明,未成熟硬脑膜来源的外泌体水凝胶能够有效促进幼鼠颅骨的生长与发育。Yapijakis C[15]等人的研究亦表明,颅骨缺损后可激活机体的修复机制,诱导硬脑膜分泌成骨相关因子和募集成骨相关细胞,从而加速骨再生过程。同时,该过程伴随着炎症防御反应的启动与缺损区域的血管再生,进而诱导缺损部位形成骨化中心,促进膜内成骨的进行,最终实现颅骨缺损的修复与骨组织的重塑。其实验结果与本实验相一致。
综上所述,未成熟硬脑膜来源的外泌体在促进幼鼠颅骨缺损修复方面具有显著的治疗效果,其作用机制主要通过增强成骨相关因子的表达、促进成骨过程实现。本研究为儿童颅骨损伤的修复提供了新的治疗思路与实验依据,具有重要的临床转化价值。
参考文献
[1] LI J, GSAXNER C, PEPE A, et al. Synthetic skull bone defects for automatic patient-specific craniofacial implant design [J]. Sci Data, 202 8(1): 36.
[2] LI B, WANG S, ZHAO Y, et al. [The latest study on biomimetic mineralized collagen-based bone materials for pediatric skull regeneration and repair] [J]. Zhongguo Xiu Fu Chong Jian Wai Ke Za Zhi, 2021, 35(3): 278-85.
[3] MEE H, ANWAR F, TIMOFEEV I, et al. Cranioplasty: A Multidisciplinary Approach [J]. Front Surg, 2022, 9: 864385.
[4] KLIEVERIK V M, MILLER K J, SINGHAL A, et al. Cranioplasty after craniectomy in pediatric patients-a systematic review [J]. Child Nerv Syst, 2019, 35(9): 1481-90.
[5] CHEN Z, LIU P, XIA X, et al. Living on the border of the CNS: Dural immune cells in health and disease [J]. Cell Immunol, 2022, 377: 104545.
[6] CARROZZINI T, POLLACI G, GORLA G, et al. Proteome Profiling of the Dura Mater in Patients with Moyamoya Angiopathy [J]. Int J M Sci, 2023, 24(13).
[7] DASGUPTA K, JEONG J. Developmental biology of the meninges [J]. Genesis, 2019, 57(5): e23288.
[8] JACOB L, DE BRITO NETO J, LENCK S, et al. Conserved meningeal lymphatic drainage circuits in mice and humans [J]. J Exp Med, 2
[9] ZHAO F, ZHU J, DONG X, et al. The Influence of Extracellular Vesicles Secreted by Dural Cells on Osteoblasts [J]. Mol Biotechnol, 2024 66(12): 3674-87.
[10] KAISER A, ILLI O E, SAILER H F, et al. Cranioplasties for congenital and acquired skull defects in children--comparison of new concept with conventional methods [J]. Eur J Pediatr Surg, 1993, 3(4): 236-40.
[11] 李烨, 李政堂, 王勇, et al. 幼龄大鼠颅骨缺损后硬脑膜相关促成骨基因的表达情况 [J]. 医学理论与实践, 2024, 37(14): 2341-4+9.
[12] ARGOUARCH A R, SCHULTZ N, YANG A C, et al. Postmortem Human Dura Mater Cells Exhibit Phenotypic, Transcriptomic and Genetic Abnormalities that Impact their Use for Disease Modeling [J]. Stem Cell Rev Rep, 2022, 18(8): 3050-65.
[13] PANWAR D, SHRIVASTAVA D, KUMAR A, et al. Efficient strategy to isolate exosomes using anti-CD63 antibodies conjugated to gold nanoparticles [J]. AMB Express, 2023, 13(1): 90.
[14] FRASSANITO P, BEEZ T. Cranial Repair in Children: Techniques, Materials, and Peculiar Issues [J]. Adv Tech Stand Neurosurg, 2024, 4
307-26.
[15] YAPIJAKIS C, PACHIS N, SOTIRIADOU T, et al. Molecular Mechanisms Involved in Craniosynostosis [J]. In Vivo, 2023, 37(1): 36-46.
作者简介:丁心怡(1997—),女,汉族,山西运城人,研究生,研究方向为神经外科
基金项目:国家自然科学基金(No.82360188);内蒙古自治区卫生健康科技计 项目项目编号 202201408;包头医学院青年科技人才发展计划,项目编号 BYJJ-QNGG202249;内蒙古公立医院科研联合基金科技计划项目: 2024GLLH0504;2024 年内蒙古自治区医师协会临床医学研究和临床新技术推广项目:YSXH2024KYF072
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)