木奶果色素的初步定性、提取工艺优化及体外抗氧化活性研究

舒吉凡 杨静田 罗雪敏
云南农业大学食品科技学院 昆明 650201
1. 前言
1.1 木奶果概述
木奶果(学名:Baccaurea ramiflora Lour):大戟科木奶果属常绿乔木,高可达 15 米,胸径达 60 厘米;叶片纸质,倒卵状长圆形、倒披针形或长圆形,上面绿色,下面黄绿色,无毛;侧脉上面扁平,下面凸起;花小,雌雄异株,无花瓣;总状圆锥花序腋生或茎生,苞片卵形或卵状披针形,棕黄色;萼片长圆状披针形,浆果状蒴果卵状或近圆球状,种子扁椭圆形或近圆形,3-4 月开花,6-10 月结果。
分布于印度、马来西亚、泰国及中国云南、海南等,是热带雨林植物代表种类之一。木奶果树体优美,果实美味,是集观赏、食用、药用为一体的多用途树种,也是一种经济价值开发潜力极高的植物。
1.2 天然色素
1.2.1 天然色素研究现状
随着社会的发展和人们生活水平的提高,人们的食品安全意识以及保健意识也在日益提高。现在食品工业中常用的食品色素包括两类:天然色素与人工合成色素。天然色素来自天然物,主要由植物组织中提取,也包括来自动物和微生物的一些色素。人工合成色素是指用人工化学合成方法所制得的有机色素,主要是以煤焦油中分离出来的苯胺染料为原料制成的。近年来,人们发现大部分合成色素均有不同程度的毒性,对人体的健康危害极大;与之相比,天然食用色素安全性较高、有的还有一定的营养和药理作用,并且着色时色调更能接近天然物的颜色,因此开发利用动植物天然食用色素资源,日益受到人们的普遍重视[1-5]。天然食用色素能够为食品提供缤纷的色彩,同时赋予食品高质量的感官品质和营养健康而愈加受到人们的关注和青睐,但是,天然食用色素的研究与开发,还存在两大难题:一是具有商业利用价值的色素资源;二是天然食用色素本身的稳定性问题,这样就导致了天然食用色素价格昂贵,在很大程度上也限制其在应用上的普及,因此找到和开发更多的天然色素已成为食用色素发展的必然趋势[6,7]。
1.2.2 各国色素发展现状
世界各国尤其是西方发达国家不仅在色素对人体健康影响方面做了大量调查和研究,而且在食用色素的管理、合成色素的使用方面均有严格的规定,多种合成色素已被禁止或严格限量使用。在世界各国使用合成色素最多时,品种多达100 余种,日本曾批准使用的合成色素有27 种,现已禁止使用其中的16 种。美国1960 年允许使用的合成色素有35 种,现仅剩下7 种。此外还有一些国家已禁止在肉类、鱼类及其加工品、水果及其制品、调味品、婴儿食品、糕点等食品中添加合成色素[8]。
目前,天然色素应用已初步发展起来,从营养,化妆品,医药品到食品添加剂,天然色素都起着可喜的成果,展现出广阔的运用前景。在21 世纪,人们渴求绿色,健康食品和回归自然的呼声中,食用天然色素研究与开发将会有广阔的发展前景。但是,由于天然色素的不稳定,运用过程中易受到一些因素影响,天然色素的应用还受到很多限制。
1.2.3 天然色素与合成色素
相对合成色素而言,天然色素更加安全,天然色素大多为花青素类、黄酮类、类胡萝卜素类化合物,且很多天然色素含有人体必需的营养物质,或本身就是维生素或具有维生素性质的物质。还有一些天然色素具有一定的药理功能,对某些疾病有预防和治疗作用。如很多天然色素在清除自由基、抗氧化、降血压、降血脂、调节免疫力、保肝护肝等方面有重要作用[9]。
1.2.4 研究意义
天然食品在加工保存过程中容易退色或变色,为了改善食品的色泽,人们常常在加工食品的过程中添加食用色素,以改善感官性质。因此,开发利用动植物天然食用色素资源,日益受到人们的普遍重视。
木奶果作为云南省的野生植物,含有丰富的多酚化合物和微量元素等功能成分,具有较好的开发空间。但是目前木奶果深加工程度不足,限制了农民增收,制约了本土产业的进一步发展。关于木奶果中色素的研究目前未见报道。本研究通过提取木奶果中的色素,利用不同的体外抗氧化试验体系对木奶果进行抗氧化活性研究,为木奶果的深加工提供新思路,促进我国色素研究的发展。
2. 材料与方法
2.1 试验时间、地点
本实验于2015 年12 月到2016 年10 月期间在云南农业大学食品科学技术学院实验室完成。
2.2 实验材料与设备
2.2.1 实验原料
木奶果
2.2.2 实验试剂
氢氧化钠,盐酸,95%乙醇,DPPH, TPTZ(三吡啶基三嗪),氯化铁,铁氰化钾等
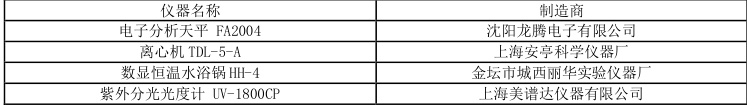
2.2.3 实验仪器
表1 主要实验仪器和设备
2.3 实验方法
2.3.1 原材料的预处理
去除木奶果表面的杂质和污垢,将木奶果切碎并进行研磨。
2.3.2 色素的初步定性
2.3.2.1 最大吸收波长及最佳提取溶剂的确定
准确称取11 份1g 样品,置于三角瓶中,分别加入配好的1%盐酸/甲醇 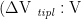 甲醇=1.87:98.13)、0.1%盐酸/甲醇 (Vtispℓ:Vηps=0 .18:99.82)、1%盐酸乙醇
甲醇=1.87:98.13)、0.1%盐酸/甲醇 (Vtispℓ:Vηps=0 .18:99.82)、1%盐酸乙醇 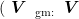 乙醇=1.86:98.14)、1%盐酸水溶液 (Vtim:V∗=3: :97)、60%甲醇水溶液、0.1%盐酸乙醇 (Vtin;Vz,n=0 .18:99.82)、60%乙醇水溶液甲醇、乙醇、蒸馏水。研磨,过滤,分别用不同的提取溶剂定容于50ml 容量瓶中,在200-1000nm 范围内测定吸光度,确定其最大吸收波长。
乙醇=1.86:98.14)、1%盐酸水溶液 (Vtim:V∗=3: :97)、60%甲醇水溶液、0.1%盐酸乙醇 (Vtin;Vz,n=0 .18:99.82)、60%乙醇水溶液甲醇、乙醇、蒸馏水。研磨,过滤,分别用不同的提取溶剂定容于50ml 容量瓶中,在200-1000nm 范围内测定吸光度,确定其最大吸收波长。
2.3.3 提取工艺优化
2.3.3.1 单因素实验
2.3.3.1.1 提取时间对色素提取效果的影响
准确称取1g 样品,以最佳提取溶剂,料液比为 1:15(g:mL) ,在室温下分别提取 10min、20min、30min、40min、50min,定容于50 mL 容量瓶中,在最大吸收波长测定吸光度。
2.3.3.1.2 提取温度对色素提取效果的影响
准确称取 1g 样品,以最佳提取溶剂,料液比为 1:15(g:mL),在室温下分别提取 10min、20min、30min、40min、50min,提取时间为30min,定容于50 mL 容量瓶中,在最大吸收波长测定吸光度。
2.3.3.1.3 液料比值色素提取效果的影响
称取 1g 样品,置于三角瓶中,置于三角瓶中后分别加入 5ml、10ml、15ml、20ml、25ml 的最佳提取溶剂,在温度为50℃情况下提取30min,后定容至50ml 容量瓶,测定吸光度,得出最佳提取液料比值。
2.3.3.1.4 提取次数对色素提取效果的影响
准确称取 1g 样品,以最佳提取溶剂,料液比为1:15(g:mL),提取时间为 30min,在室温下分别提取 1 次、2 次、3 次、4 次,定容于50 mL 容量瓶中,在最大吸收波长测定吸光度。
2.3.3.1.4 提取酒精度对色素提取效果的影响
称取 1g 样品,置于三角瓶中,置于三角瓶中后分别用10%、20%、30%、40%、50%、60%、70%、80%、90%、100%的酒精定容于50 mL 容量瓶中,在最大吸收波长测定吸光度。
2.3.3.2 响应面试验设计
在单因素实验的基础上,利用 DPS 数据处理软件,进行 4 因素 5 水平响应面试验设计,优化该色素的最佳提取工艺。
2.3.4 色素体外抗氧化性测定
2.3.4.1 色素溶液的制备
取1g 木奶果碎片放于三角瓶中,按最优提取条件提取木奶果色素,提取后定容于 50ml 容量瓶备用。
2.3.4.2 色素体外抗氧化性测定
2.3.4.2.1 DPPH 自由基清除能力测定[6]
分别取0.5mL 色素提取液,添加2 mL 100mmol/L DPPH 甲醇溶液,涡旋振摇后,混合物室温下暗处放置10min,然后在517nm 比色测定;并根据阿魏酸标准曲线 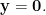 .9406x +28.698 计算 DPPH 自由基的清除能力。
.9406x +28.698 计算 DPPH 自由基的清除能力。
自由基清除能力(%) =[ (A0-A1)/A0] ×100
A0为对照吸光度,A1为样品的吸光度。
自由基清除能力表示为每g 面粉中提取的色素溶液含有相当于阿魏酸的µg 数。
2.3.4.2.2 铁离子还原/抗氧化能力测定(FRAP)
2.3.4.2.2.1 溶液配制:
FRAP 溶液的制备: 10mL 乙酸溶液、1mL6H2O.FeCl3 和 1mL 三吡啶基三嗪(TPTZ)充分混匀(V:V:V=10:1:1);2.3.4.2.2.2 铁离子还原能力测定:
100µL 测试样品加入3mLFRAP 溶液充分混合,混匀后于37℃下放置,4min 后在593nm 测定吸光度,并根据阿魏酸标准曲线y=6.24x +0.0005 计算铁离子还原能力。
2.3.4.2.3 总抗氧化能力测定(TEAC)[8
2.3.4.2.3.1 溶液配制
ABTS·+工作液配制:将ABTS 与过硫酸钾两种溶液等体积混合,得到ABTS·+工作液配制。
2.3.4.2.3.2 总抗氧化能力测定:
50μl 样品粗提液加入3.8ml 稀释后的ABTS·+工作液,室温下放置6min 后于734nm 测定吸光度;并根据阿魏酸标准曲线 y=5.3827x +3.3472 计算总抗氧化能力。
自由基清除能力(%)=[(A0-A1)/A0] ×100 ①
A0为对照吸光度,
A1为样品的吸光度
2.3.4.2.4 还原能力测定
2.3.4.2.4.1 还原能力的测
在离心管中,1ml 色素提液加入2.5ml 磷酸盐,2.5ml 铁氰化钾溶液,混合物于50℃下保温 20min ;加入2.5 mL 10% TCA 溶液,于 4000g 离心10 min;取上清转移到离心管中,加入离子水和FeCl3溶液,于700nm 读吸光度;并根据阿魏酸标准曲线y=0.0455x +0.115 计算其还原能力。
2.3.4.2.5 过氧化氢(H2O2)清除活性测定[9]
2.3.4.2.5.1 过氧化氢清除活性测定:
色素提液 0.6mL,加入 0.9 mL H2O2 (40mM),然后加入 1.5mL 45 mM 磷酸钠缓冲溶液(pH 7.4); 30℃暗处反应40min,于230nm 测定吸光度;并根据阿魏酸标准曲线 y=0 .6571x +11.119 计算过氧化氢清除活性。
自由基清除能力(%)=[(A0-A1)/A0] ×100 ①
A0为对照吸光度,
A1为样品的吸光度
3. 结果与分析
3.1 最佳提取溶剂及最大吸收波长的确定
吸收曲线如图1:
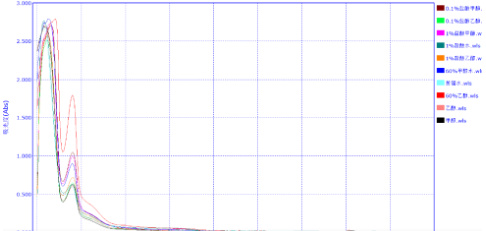
由图1 可以看出,该色素在波长为280nm 处有最大吸收峰,说明该色素可能为去甲汉黄芩素。 在最大吸收峰下,60%乙醇的色素溶液吸光度最大,故选取乙醇作为提取溶剂。
3.2 提取工艺参数的确定
3.2.1 单因素结果与分析
3.2.1.1 提取时间对色素提取效果的影响
提取时间对色素提取效果有一定的影响,提取时间越长,色素提取效果越好,但是稳定性会降低。
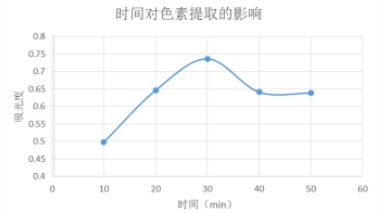
图3 时间对色素提取效果的影响
由图 3 可以看出,提取时间越长,木奶果色素的吸光度越大,提取效果越好,在 30min 时达到最高,然后呈下降趋势,可能是提取时间过长,色素在光、氧气存在的条件下不稳定所致。所以选择提取时间为30min。3.2.1.2 提取温度对色素提取效果的影响
提取温度对色素提取效果有一定的影响,随着温度的升高,色素提取效果会变好,但是温度过高可能导致色素稳定性下降,发生降解。
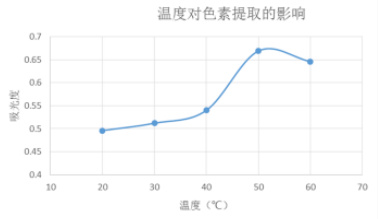
图4 温度对色素提取效果的影响
由图 4 可见,随着提取温度的升高,木奶果色素的吸光度呈现上升趋势,色素的提取效果也变好,在 50℃时达到最大值,然后随温度的升高,吸光度呈现降低趋势,色素的提取效果也会降低。可能是该色素在高温条件下不稳定,导致色素分解,从而影响了提取效果,所以选择50℃作为提取温度。
3.2.1.3 料液比对色素提取效果的影响
料液比对色素的提取影响较大,随料液比的增加,色素的提取效果变好,但是会增加提取溶剂的用量,增加提取成本。
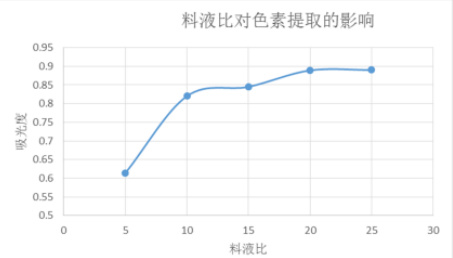
图5 料液比对色素提取效果的影响
由图 5 可见,随着料液比的升高,色素吸光度呈现上升趋势,说明色素提取效果变好,但从料液比为 1:15(g:ml)以后溶液的吸光度增加不太明显。从减少提取溶剂用量和浓缩色素方面考虑,选择 1:15(g:ml)的料液比比较理想。
3.2.1.4 提取次数对色素提取效果的影响
提取次数对色素的影响较大,但是随提取次数的增加,提取溶剂用量会增加,且色素稳定性会降低。
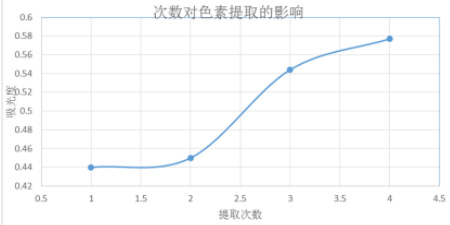
图2 提取次数对色素提取效果的影响
由图2 可见,随着提取次数的增加,木奶果色素的吸光度逐渐增大。最好的提取次数为4 次。
3.2.2 响应面试验设
3.2.2.1 数学模型的建立与检验
响应面实验设计及实验结果见表3。利用DPS 软件对试验结果进行分析,得到响应面模型:
Y=0.540833-0.01579X1+0.033208X2+0.038358X3+0. 042042Xi+0. .015688X1X2+0.000563X1X3+0.007813X1X4-0.00794X2X3-0.01169X2X4-0.00056X3X4-0.04049X1 -0.00374X2 -0.01024X3 -0.02036X4
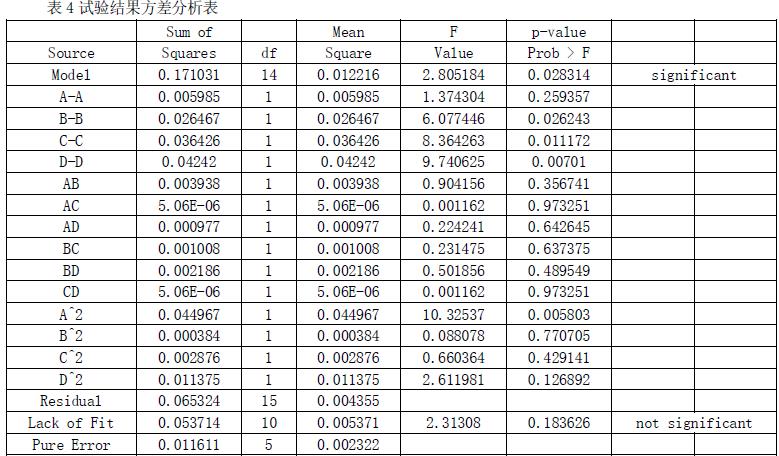

根据试验结果进行方差分析(表4)可知,拟合检验 p=0 .183626>0.05,达到显著水平,说明方程由于实际情况拟合良好,可行,能够反映色素提取效果与提取温度、提取时间、酒精度和料液比的关系。
3.2.2.2 变量转换直接寻优
根据已建立的数学模型, 在-1.682≤Xi≤1.682( j=1 ,2,3)范围内,每个因素取 5 个水平(±1.682,±1 ,0),对 5s=125 个方案进行统计寻优, 在试验范围内可得吸光度的最高值为 0.615, 此时各因素取值为:X1=-1 , Xz=-1 .682, X3=1 .682,X4=1 对应着提取温度为 51.14℃,液料比为 19.99:1,提取时间为 39.9min,酒精度 37.47%。
3.2 色素体外抗氧化性测定
3.2.1 DPPH 自由基清除率能力测定
3.2.1.1 原理
DPPH 的甲醇溶液是一种较为稳定的自由基,呈紫红色,在517nm 处有最大吸收值。当向DPPH 的甲醇溶液中加入具有清除自由基功能的色素时,具有清除自由基功能的色素会与DPPH 的单电子配对,颜色变浅,吸光值就会变小,这种颜色变浅的程度与配对电子数成线性关系。因此,可通过吸光值的变化来反应色素是否具有抗氧化性,颜色变化越大抗氧化效果越好。清除率以阿魏酸已知量质量浓度转变成质量来表示对自由基的清除能力[10]。
3.2.1.2 样品 DPPH 自由基清除能力计算将所测的吸光度值,带入①式中计算出自由基清除能力y(%)
将木奶果色素的清除率 y(%)带入标准方程: y=0 .009406x + 0.28698,R2=0.969 中计算出样品相应的阿魏酸量,定义为当量浓度(清除能力值)。结果表示为每g 样品中相当于阿魏酸的量(μg)。所得到的结果为木奶果色素DPPH 自由基清除能力为92.26%,每g 样品中提取的色素DPPH 自由基清除率相当于阿魏酸的量为609197μg。
3.2.2 铁离子还原/抗氧化能力测定(FRAP)
3.2.2.1 原理
FRAP 法基于氧化还原反应,在酸性 pH 值下,Fe3+与 TPTZ 形成复合物(Fe3+-TPTZ)在还原物质的作用下,由于TPTZ 中的Fe3+可被样品中还原物质还原为Fe2+ , 呈现出明显的蓝色, 并于593nm 处具有最大吸收峰, 由吸光度大小可计算样品抗氧化活性的强弱。以FeSO4 为标准溶液,根据反应后的A 值,在标准曲线上求得相应的FeSO4的浓度(m mol/L)义为当量浓度(RAP 值)结果表示为每 g 样品中相当于 FeS04 的毫摩尔量(mmolFeSO4)。FRAP值越大表明由抗氧化物质还原的二价铁离子越多,即抗氧化物质抗氧化活性越强 。
3.2.2.2 样品对铁离子的还原能力计算
根据标准曲线,将样品的所测得到的吸光度值带入标准曲线的回归方程 y=6. .24 x+0 .0005 , R2=0 .9984方程中,计算出样品相应的FeSO4的浓度(m mol/L),定义为当量浓度(FRAP 值)。结果表示为每g 样品中相当于 FeS04的微摩尔量(μ mol)[15]。
所得到的结果为在木奶果色素中,每g 样品中提取的色素铁离子还原能力相当于FeSO4 的量为19. 92mmol 。
3.2.3 总抗氧化能力测定(TEAC)
3.2.3.1 原理
ABTS 法又称为 TEAC 法,是使用最广泛的间接检测法,可用于亲水性和亲脂性物质抗氧化能力测定。ABTS经氧化后生成稳定的蓝绿色阳离子自由基ABTS+,能溶于水相或酸性乙醇介质中,在734nm 处有最大吸收。被测物质加入 ABTS+溶液后,所含抗氧化成分能与ABTS+发生反应而使反应体系褪色。在 ABTS+的最大吸收波长检测吸光度的变化。并与Trolox 标准对照体系比较就能换算出被测物质总的抗氧化能力 。
3.2.3.2 样品总抗氧化能力的计算将所测的吸光度值,带入①式中计算出自由基清除能力y(%)
根据曲线图,将木奶果色素的清除率 y(%)带入标准方程: y=0. .053827x +0.033472 , R2= 0. .9997 中计算出样品相应的Trolox 的量,定义为当量浓度(清除能力值)。结果表示为每 g 样品中相当于Trolox 的量(μg)。所得到的结果为木奶果色素总抗氧化性自由基清除率为13.83%,每g 样品中提取的色素自由基清除能力相当于 Trolox 的量为 128382.17μg。
3.2.4 还原能力测定
3.2.4.1 原理
抗氧化剂(还原剂)是通过自身的还原作用,给出电子而清除自由基的,还原能力越强,抗氧化性越强。实验中,样品的抗氧化剂能使铁氰化钾的三价铁还原成二价铁(亚铁氰化钾),二价铁(亚铁氰化钾)进一步在和三氯化铁的反应下生成在700nm 处有最大吸光度的普鲁士蓝(Fe4[Fe(CN)6]3),因此测定 700nm 处的高低可以间接反映抗氧化剂的还原能力大小,吸光度越大,还原能力越强。
3.2.4.2 样品还原能力的计算
根据标准曲线,将样品的所测得到的吸光度值带入标准曲线的回归方程标准方程: y=0 .0455 X+0. 115,R2=0 .9916 方程中,计算出样品相应的抗坏血酸的含量(μg)。结果表示为每g 样品的还原能力表示为相当于的微克数(μg)。
所得到的结果为在木奶果色素中,每g 样品中提取的色素还原能力相当于抗坏血酸的量为566.35μg。
3.2.5 过氧化氢(H2O2)清除活性测定
人体内含有氧离子自由基,在体内由过氧化物歧化酶消除,当把色素溶液加入过氧化氢磷酸盐缓冲液中时,氧离子自由基被清除,在230nm 测吸光度值,吸光度降低。
3.2.5.2 过氧化氢(H2O2)清除活性计算将所测的吸光度值,带入①式中计算出自由基清除能力y(%)。
根据曲线图,将木奶果色素的清除率y(%)带入标准方程: y=0 .
中计算出样品相应的阿魏酸的量,定义为当量浓度(清除能力值)。结果表示为每 g 样品中相当于阿魏酸的量(μg)。
所得到的结果为木奶果色素过氧化氢清除率为1.92%,每g 样品中提取的色素自由基清除能力相当于阿魏酸的量为 25493.09μg。
4.结论
4.1 色素的最优提取工艺确定
4.1.1 木奶果色素的最佳提取溶剂是:30%酒精。
4.1.2 木奶果色素的单因素提取条件为:提取4 次,提取时间为30min,料液比为1:15,提取温度为50℃。4.1.3 木奶果色素最优提取条件为:提取温度为 51.14℃,液料比为 19.99:1,提取时间为39.9min,酒精度 37.47%。
4.2 体外抗氧化性
4.2.1 木奶果色素DPPH 自由基清除能力为92.26%,每g 样品中提取的色素DPPH 自由基清除率相当于阿魏酸的量为 609197.29μg。
4.2.2 在木奶果色素中,每g 样品中提取的色素铁离子还原能力相当于FeSO4 的量为19.92mmol。
4.2.3 木奶果色素总抗氧化性自由基清除率为 13.83%,每 g 样品中提取的色素自由基清除能力相当于Trolox 的量为 128382.17μg。
4.2.4 在木奶果色素中,每g 样品中提取的色素还原能力相当于抗坏血酸的量为566. 35μg 。
4.2.5 木奶果色素过氧化氢清除率为 1.92%,每 g 样品中提取的色素自由基清除能力相当于阿魏酸的量为25493.09μg。
5.意义
本实验通过单因素实验、响应面试验设计和五种体外抗氧化测定体系对木奶果色素进行研究,对木奶果色素的开发利用奠定了基础,对木奶果产业的发展有促进作用,同时也对木奶果的研究具有重要的理论与实践价值。
参考文献:
[1]余芳,彭常安.食用色素及其安全性分析[J]. 芜湖职业技术学院学报,2002,9(3),20-22.
[2]唐传核.花色苷类的生理功能[J].中国食品用化学品,1999,5:27-28,31.
[3]张书勤,王红生.合成食用色素的性质及分析方法[J].天中学刊,1999,14(2):31—34
[4]林森.精细化工生产配方与应用手册[M].南昌:江西科技出版社,1999.11—13
[5] 王威.常用天然色素抗氧活性的研究[J].食品科学,2003,24(6):96~100
[6]马自超,庞业珍.天然食用色素化学及生产工艺学[M].北京:中国林业出版社,1994
[7]黎欹,黄小凤,李中林.利用苦瓜子衣废料制备食用色素的研究.林产化工通讯,2003,37(2):3-7
[8] 杨洋.国内外天然食品抗氧化剂的研究进展[J]. 食品科学,2002,23(10):138~140
[9] 张丙华,张晖,朱科学.谷物色素研究进展[J]. 粮食与食品工业,2009,16(4):18~21
[10] 杨少辉,宋英今,王洁华.雪莲果体外抗氧化和自由基清除能力.食品科学2010:167~169
[11] 韩洪坤,杨晓彤,杨庆尧等.铁离子还原法(FRAP)测定中国被毛孢菌丝体提取物抗氧化活性[J].上海师范大学学报,2011,40(3),231~234
[12] 周昇昇.抗氧化能力体外评价方法的进展和比较[J].卫生研究,2010,39(2):165~167
[13] 王立峰.3 种薏米的多酚提取物清除过氧化氢自由基抗氧化能力评价[J].食品科学,2012 33(19):39~
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)