丙戊酸钠缓释片处方工艺及质量研究

杜雪朋
上海智同医药科技有限公司 上海 200000
引言
丙戊酸钠缓释片是一种广谱抗癫痫药物,主要作用于中枢神经系统,通过调节 ΨΨ -氨基丁酸(GABA)的代谢,增加其在突触间隙的浓度,进而增强中枢神经系统的抑制性神经传递,有效控制癫痫发作[1]。随着医疗需求的不断提升,以及国家医疗政策方面的改革,进行丙戊酸钠缓释片国产化生产具有可行性,但丙戊酸钠缓释片仿制药的临床开发面临多维度挑战,且部分医生对国产仿制药的缓释效果持保留态度,倾向选择原研药。此背景下,本次对丙戊酸钠缓释片处方工艺进行研究,通过精准工艺控制与严格质量体系,逐步打破进口垄断,实现临床价值与经济效益的双赢。
1 研发背景
本品原研持证商为 Sanofi Aventis France,生产商为 Sanofi Winthrop Industrie,于 1987 年 12 月首先在法国批准上市,商品名为 Depakine Chrono,规格为 500mg(以丙戊酸钠计)。原研于 2002 年01 月在国内获批进口上市,规格为 0.5g(以丙戊酸钠计)。本项目选择Sanofi Aventis France 持证欧盟上市的规格为 500mg(以丙戊酸钠计)的丙戊酸钠缓释片(商品名为Depakine Chrono)作为参比制剂,进行仿制药的开发,仿制规格和剂型均与参比制剂一致。
2 丙戊酸钠缓释片处方及工艺研究
2.1 处方组成
根据法国上市的原研说明书中公开该产品的非活性成分可知原研内容物的主要组成包括:丙戊酸钠、丙戊酸、乙基纤维素(20mPa.s)、羟丙甲纤维素(3000mPa.s)、无水胶态二氧化硅、水合二氧化硅、糖精钠、聚丙烯酸酯 30%(EUDRAGITE30D)、羟丙甲纤维素(6mPa.s)、聚乙二醇 6000、滑石粉、二氧化钛;俄罗斯上市药品说明书中公开的成分组成:丙戊酸钠、丙戊酸、乙基纤维素(20mPa.s)、羟丙甲纤维素(4000mPa.s)、无水二氧化硅、水合二氧化硅、糖精钠、丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体、羟丙甲纤维素(6 mPa.s)、聚乙二醇6000、滑石粉、二氧化钛。
结合对以上两种药物组成的分析,本次自研制剂采用和参比制剂相同的辅料,以羟丙甲纤维素(E4M CR)为缓释骨架材料,乙基纤维素为粘合剂、胶态二氧化硅和凝胶二氧化硅为助流剂,糖精钠为矫味剂,丙烯酸乙酯-甲基丙烯酸甲酯共聚物水分散体、羟丙甲纤维素(SH-E5)、聚乙二醇6000、滑石粉为包衣材料。
2.2 原料及辅料
原料药为丙戊酸钠和丙戊酸,其中丙戊酸钠引湿性较强,在小试开发阶段容易引起压片阶段的粘冲风险,在经过不同操作环境对比研究,最终控制湿度为<40%RH;且处方中选用凝胶二氧化硅作为吸附剂,可以较好的防护丙戊酸钠引湿性,另由于丙戊酸为液体,加入形式为湿法制粒阶段的雾化加入,辅料中选择凝胶二氧化硅作为吸附剂,也起到防护丙戊酸分散后出现聚集从而引起粘冲、片剂外观不合格风险。
2.3 处方筛选
本次丙戊酸钠缓释片处方工艺研发,是对国外原始药物的仿制,为了保障药物的实用性,积极展开对处方药物组成的筛选工作。根据药物组方中的原料设定,对处方组成中的乙基纤维素用量进行筛选,由于原研资料中有关于该材料粘度筛选,故本次筛选过程中,重点对其用量进行了分析,以干整后颗粒性质(粒径分布和堆密度),素片的溶出曲线(篮法-pH1.0-100rpm),剂量倾泄乙醇浓度 0% 、20%、40%为评价指标,确定处方中乙基纤维素的用量。综合考量下,自制制剂乙基纤维素用量选择:12.0mg/片;对羟丙甲纤维素型号筛选,市售羟丙甲纤维素可选型号有 K4M CR、E4M CR,以素片的溶出曲线(篮法-pH1.0-100rpm),剂量倾泄 0% 、20%、40%和静态崩解外观为评价指标,确定处方中羟丙甲纤维素的型号,确定为 E4M CR;对羟丙甲纤维素 E4M CR 用量进行筛选,参照乙基纤维素用量评价指标,确认自制制剂羟丙甲纤维素用量为:176.0mg/片;经试验分析,凝胶二氧化硅,用量为50mg/片。最终,确定处方工艺:骨架材料选择羟丙甲纤维素,型号拟定为E4M CR;粘合剂选择乙基纤维素,型号为 Ec 20cp;胶态二氧化硅为助流剂,型号为 AEROSIL 200;凝胶二氧化硅为助流剂,型号为 244FP;丙烯酸乙酯-甲基丙烯酸甲酯共聚物为主要成膜材料[2]。
2.4 制备工艺
在对丙戊酸钠缓释片制备工艺进行研发时,充分对原研工艺进行了分析,结合实际情况,丙戊酸钠缓释片参比制剂为白色包衣片,片芯为白色粉末和部分颗粒物,从处方组成来看,处方中乙基纤维素可作为骨架缓释片的粘合剂,且原料药组成中丙戊酸为液体,故推测参比制剂可能采用湿法制粒工艺。鉴于此,综合考量本次自研需求,决定选用高速剪切湿法制粒工艺。主要工艺步骤包括预混、制粒、湿法整粒、干整粒、总混、压片和包衣。其原理为:通过使用专用设备对原料进行高速切碎,切碎过程中同步进行搅拌,使物料混合。搅拌环节,适当添加粘合剂,均匀喷撒到物料中,物料粉末在黏合剂的作用下逐渐聚集成小颗粒,之后再经过进一步的搅拌和剪切,颗粒不断增大并达到所需的粒度大小和形状。该制备工艺呈现出较多的优势,制粒效率高,制粒过程一般在几分钟之内即可完成,生产效率可观;颗粒质量良好,药物颗粒制备完成后,颗粒度均匀、流动性好,具有较高的密度和强度,能够满足后续制剂包装要求。另外,还能够较好地控制颗粒形状、大小分布;适宜自动化生产加工。
2.5 包材
本品采用瓶装包装方案,包装组成为:口服固体药用高密度聚乙烯瓶、口服固体药用聚丙烯压旋盖、药用聚酯/铝/聚乙烯封口垫片和口服固体药用纸袋装硅胶干燥剂,外包装为纸盒。考虑到原料药丙戊酸钠具有强引湿性,为此,对不同加速条件下的干燥剂用量进行考察,主要是考察 1g/袋、2g/袋对于包材防潮性能的影响。试验结果表明,1g/袋、2g/袋干燥剂内置于内包装条件下,样品在加速条件 6M 下稳定,有关物质、含量和溶出曲线(pH 6.8-篮法-60rpm)无显著变化,因此本品选择1g/袋干燥剂用量作为自制制剂包材。在后续对研发药品的储存稳定性观察中,持续观察了 6 个月,结果表明,所用的包装材料对产品有较好的保护作用,满足样品包装的要求,本品采用瓶装,具有便于携带、减少了药品在携带和服用过程中的相关污染[3]。
3 自制制剂和参比制剂对比研究
3.1 质量对比
在性状方面,参比制剂为薄膜衣片,除去包衣后显白色;自制制剂为薄膜衣片,除去包衣后显白色。由此,表明,自制制剂与餐补制剂在性状方面呈现一致性。
在对药物中的有效成分含量测定过程中,采用色谱法进行分析,结果供试品溶液主峰的保留时间与对照品溶液主峰的保留时间一致,表明,自制制剂和参比制剂在药物有效成分含量方面均符合标准规定。
在对药物制剂中的丙戊酸钠进行检出时,每片药物中的丙戊酸钠含量应为 308~358mg。实际的检出结果表明,参比制剂:331\~339;自制制剂:316-332。符合标准范围。
在溶出度对比方面,标准为:在1 小时、3 小时、6 小时和 12 小时时的溶出量应分别为标示量的 10%\~30%、30%\~50%、50%\~70%和70%以上。结果自制制剂和参比制剂的溶出度均符合规定。
在总杂质检出方面,标准为: ⩽0.4% 。参比制剂检测结果 <0.05%; ;自制制剂的总杂质在 0.05%\~0.06 范围,符合标准要求。
在微生物检出方面,标准为:需氧菌总数:≤103cfu/g;需氧菌总数: ⩽ 102cfu/g;大肠埃希菌:每 1g 中不得检出。  比制剂检测结果,未检测出相关微生物。自制制剂结果为:需氧菌总数<20 cfu/g;需氧菌总数 <20 cfu/g;大肠埃希菌: ☉ 1g 中未检出。
比制剂检测结果,未检测出相关微生物。自制制剂结果为:需氧菌总数<20 cfu/g;需氧菌总数 <20 cfu/g;大肠埃希菌: ☉ 1g 中未检出。
由此表明,自制制剂和参比制剂的质量相近,均符合标准要求[4]。
3.2 剂量倾泄
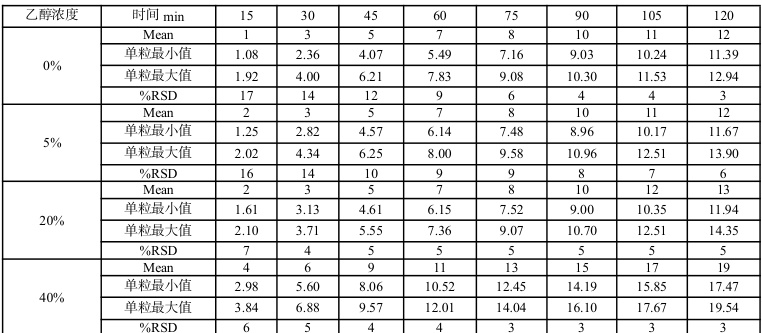
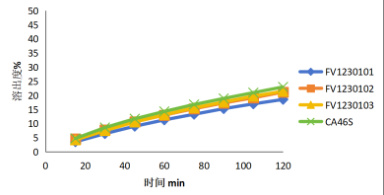
参考《化学仿制药口服调释制剂乙醇剂量倾泄试验药学研究技术指导原则》,对比研究参比制剂 CA46S 和工艺验证批次FV1230101、FV1230102、FV1230103 批次在 pH 1.0 盐酸介质+乙醇浓度 0%、5%、20%、40%条件下的释放情况。其中,CA46S、FV1230101 倾泄考察数据如表 1、表2 所示。对比结果表明,三批自制制剂和参比制剂在不同水平浓度乙醇条件下释放趋势一致,20%乙醇浓度下没有明显释放增长,40%乙醇浓度下参比制剂和自制制剂有明显上升趋势。其中40%乙醇浓度自制和参比制剂剂量倾泄曲线如图 1 所示。
表1 CA46S 样品剂量倾泄考察数据
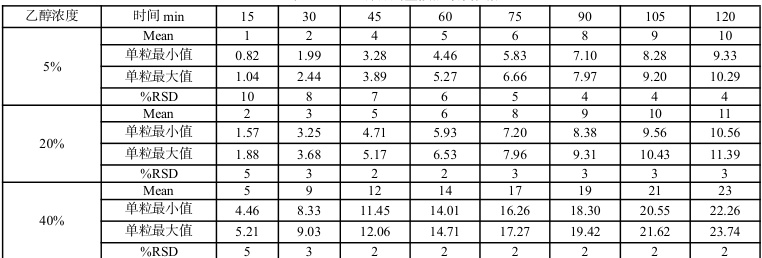
表 2 FV1230101 样品剂量倾泄考察数据
40%乙醇浓度自制和参比制剂剂量倾泄曲线
图1 乙醇浓度 40%自制和参比制剂剂量倾泄曲线
3.3 刻痕研究
本品为刻痕片,参考说明书中可以进行掰片服用,参考《化学仿制药口服片剂功能性刻痕设计和研究技术指导原则(试行)》,对自制制剂和参比制剂进行对比研究,主要内容:掰片片重差异、重量损失、脆碎度、溶出度和稳定性。
在掰片片重差异检测过程中,分别随机选取参比制剂、自制制剂 30 整片,用手掰(30 片)和切片器切开(30 片),取每片分割后的部分进行称重,计算平均重量。分割后部分重量超出平均重量的 85% \~115%的不能多于一个,若有一个以上出现,则表明不合格。结果表明,参比制剂与自制制剂的掰片片重差异无明显的异常现象,均符合限定要求,呈现合格状态。
在对重量损失进行测定时,取参比制剂和批次样品各 15 整片,考察自制制剂和参比制剂的掰片损失。分割后部分  分片共 30 个半片)与 15 整片相比,重量损失超过3.0%则表明不合格,掰片过程中的药片碎屑不计入计算重量损失。结果自制制剂与参比制剂的损失均在 3.0%以内。
分片共 30 个半片)与 15 整片相比,重量损失超过3.0%则表明不合格,掰片过程中的药片碎屑不计入计算重量损失。结果自制制剂与参比制剂的损失均在 3.0%以内。
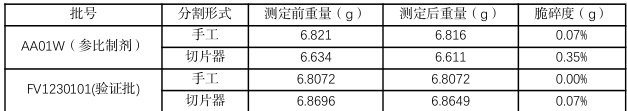
对于掰片脆碎度测定,分别选取参比制剂、自制制剂批次样品若干,结果应符合《中国药典》“片剂脆碎度检查法”的要求,展开测定。其部分结果如表 3 所示,符合《中国药典》规定。
在溶出曲线对比方面,取批次样品与参比制剂 AA01W 各 12 片,手工掰开,拟定硬度范围的上限和下限处分别取分割后部分与整片检测溶出曲线(pH 6.8),比较相似因子(f2),应满足溶出曲线结果相似因子 f2>50AA 结果半片溶出曲线和整片溶出曲线数据相似因子 f2>50 ,符合要求。
在稳定性方面,随机取一定量验证批次样品,手动掰开后放置原聚丙烯包装瓶中,拧好瓶盖后放置,在 30℃/65%RH 条件下放置 1M,2M,3M。之后,取出检测外观、含量、有关物质、溶出度,对比自制制剂和参比制剂检测结果。结果显示,自制制剂和参比制剂各项检测指标无明显差异[5]。
表3 脆碎度检测数据表
4 结论
综上所述,此次戊酸钠缓释片处方工艺最终顺利研发实现,当前,基于该处方工艺下的药物已顺利完成工艺验证三批生产,注册申报资料已递交 CDE,其稳定性考察已进行至 24M,数据显示符合质量标准要求,产品稳定性良好。研发过程中,深入参考原研资料,在此基础上对工艺路径进行逐步探索、优化,从而给出适宜的工艺方案。本次丙戊酸钠缓释片在临床试验过程中正式BE 通过,该药物的国产化生产,利于打破国外垄断,进而减低药品生产成本,提升临床综合疗效率,有效改善患者生活质量。
参考文献:
[1] 齐红艳.“药片虽小,注意事项可不少”之丙戊酸钠缓释片[J].药物与人,2024,(01):82-86.
[2] 黄荣,丙戊酸钠原料药的工艺开发及质量研究.四川省,四川科瑞德制药股份有限公司,2023-02-24.
[3] 王丹丹,金宏,蔡荣,等.中国国家药包材标准体系的沿革与启示[J].医药导报,2023,42(8):1123-1129.
[4] 崔亚宁,邓颖鹏,张思楠,等.咪唑斯汀缓释片仿制药与原研药质量对比研究[J].中国药业,2023,32(10):76-80.
[5] 付清爽,姚旭,周玲玲,等.对乙酰氨基酚片使用期间稳定性及刻痕分割能力质量评价[J].药学研究,2025,44(02):141-144.
作者简介:杜雪朋,男,汉族,1989.02-,江苏东海人,本科,助理工程师,研究方向:药物研发
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)