荧光法生物气溶胶监测仪的抗干扰技术研究

陈斌 张佩 王光辉 刘定高 杨晓佳 朱菁
上海镭慎光电科技有限公司 上海 201899
1 引言
生物气溶胶是空气中含有微生物(如细菌、病毒、真菌)及其代谢产物的悬浮颗粒,其存在与传播直接影响公共卫生安全、环境监测及生物反恐领域。世界卫生组织指出,空气中病原微生物的气溶胶传播是呼吸道疾病暴发的重要途径[1]。近年来,全球范围内突发性传染病频发(如COVID-19 疫情),使得生物气溶胶的实时监测技术受到空前重视。传统检测方法如培养法、PCR 技术虽具备高特异性,但存在检测周期长、操作复杂等问题[2],难以满足实时监测需求。荧光法的生物气溶胶监测技术因其快速响应(毫秒级)、原位检测等优势,成为生物安全监测领域的研究热点[3]。
荧光法生物气溶胶监测仪的核心原理是通过短波长激光激发生物颗粒内源性荧光物质(如色氨酸、核黄素),通过检测特定波长的荧光信号实现生物与非生物气溶胶的区分[4]。然而,实际应用中发现,环境中的非生物颗粒(如矿物粉尘、燃烧烟尘、花粉等)可能因含有类黄酮、多环芳烃等物质而产生交叉荧光,导致仪器误报率显著升高[5]。在复杂城市环境中,传统归一化本征荧光法难以分辨气溶胶成分中的生物粒子和非生物粒子,严重制约了其在关键场所(如医院、机场)的可靠性。因此,如何提升荧光法生物气溶胶监测仪的抗干扰能力,已成为该技术实用化的核心挑战。
近年来,国内外学者针对荧光法抗干扰技术开展了多维度探索。在硬件层面,研究聚焦于多波长激发-发射光谱联用技术。例如,Savage 等开发了 355nm/445nm 双激发光源系统,通过区分不同生物分子的荧光衰减特性,将干扰颗粒的误判率降低 18%[6] 。在算法层面,基于机器学习的模式识别方法被广泛采用。Zheng 等提出基于随机森林(Random Forest)的多光谱特征分类算法,在实验室条件下实现了 92.3% 的生物颗粒识别准确率[7]。此外,气溶胶单颗粒多参数检测技术(如散射光强度、粒径分布与荧光信号的协同分析)也为抗干扰设计提供了新思路[8]。然而,现有技术仍存在局限性:多光谱联用系统复杂度高,难以小型化[9];机器学习模型依赖大规模标注数据集,在未知环境中的泛化能力不足[10];多参数融合算法的实时性有待提升[11]。
本团队针对上述问题,于2023 年提出了基于归一化荧光信号的气溶胶分类技术研究,实现了对细菌、核黄素、香烟烟雾、汽车尾气、荧光微球等不同气溶胶的初步分类[12],但是测试样品种类数量有限。为了更全面评估其抗干扰能力并探索更精确的分类模型,本文进一步对酒精、氯化钠(NaCl)、过氧化氢( H2O2 )等干扰物开展测试研究。
2 仪器的工作原理
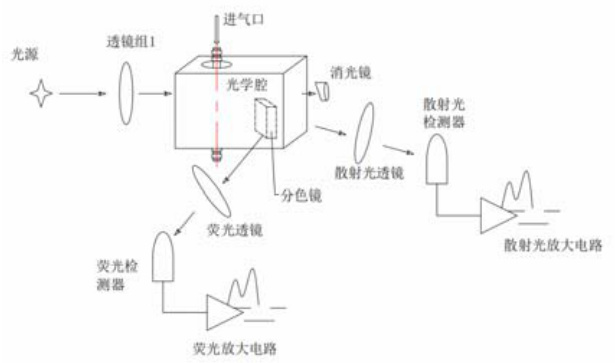
荧光法生物气溶胶监测仪是基于弹性光散射测量技术和激光诱导荧光检测技术研制的生物粒子报警仪器。激光照射在空气中悬浮颗粒物上会发生米氏散射,收集颗粒物的弹性散射光,由散射光强弱来辨别粒子粒径,由散射光的个数来对粒子进行计数的方法称为弹性光散射测量法;生物粒子内部含有苯基丙氨酸、酪氨酸、色氨酸、烟酰胺腺嘌呤二核苷酸(NADH)和核黄素等表征生物活性的有机分子,在紫外光诱导下会产生本征荧光,利用本征荧光特性判别生物粒子的生物属性的方法称为激光诱导荧光检测法。结合以上两个技术,荧光法生物气溶胶监测仪不仅可以实时的监测空气中粒子数,并且可以区分该粒子是否是荧光粒子,最后经过数据处理可以得到生物粒子数。
仪器工作原理图如图 1 所示:光源经透镜组整形聚焦后,由消光镜射出并吸收多余光源以降低噪声;分色镜使散射光直接穿过、荧光折射;散射光与荧光分别经透镜组聚焦至对应检测器,通过信号放大电路处理。当气泵抽气时,悬浮颗粒进入光学腔:非生物颗粒仅产生散射光,生物活性粒子同时产生散射光与荧光,通过同步检测两类信号可区分生物与非生物粒子,最终经数据处理得到生物粒子数。
3 荧光法生物气溶胶监测仪抗干扰实验
对于酒精、酵母菌、牛奶、84 消毒液和过过氧化氢( H2O2 )无法采用气溶胶发生器的样品,采用喷雾瓶直接在仪器进气口附近喷雾形成气溶胶颗粒进行测试。氯化钠(NaCl)、炭疽芽孢、金黄色葡萄球菌(金葡)和(BHI)培养基置于气溶胶发生器中分别产生目标气溶胶。芍药花粉置于仪器进气口上方用手指轻搓产生气溶胶颗粒。
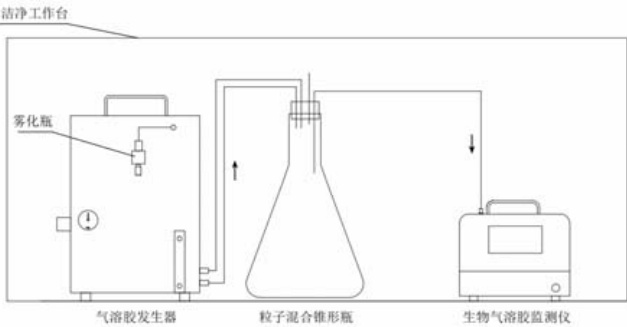
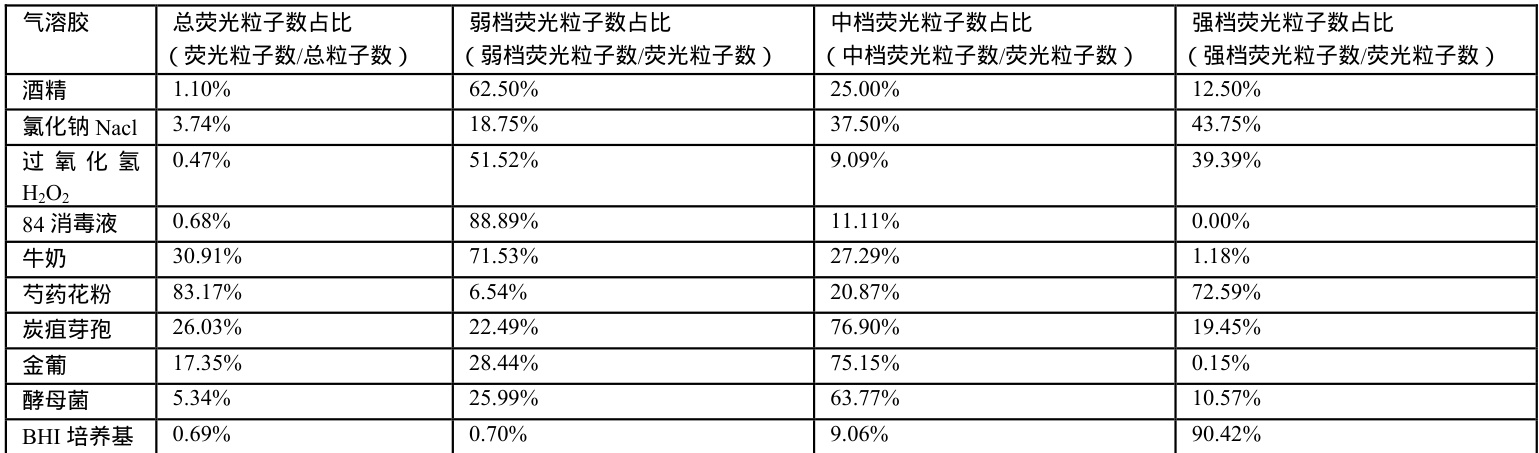
利用仪器对上述每种样品进行检测,记录10 组不同浓度的检测结果计算出平均值做成表格如下表1 所示。
荧光法生物气溶胶监测仪显示界面如图 3 所示,该界面实时显示环境中的总粒子数、荧光粒子数和归一化荧光粒子数,归一化荧光粒子数分为弱档、中档和强档,计算出每个档位的荧光粒子占总荧光粒子的比例,将结果做成柱状图,纵坐标为荧光粒子占百分比。

在洁净工作台中使用气溶胶发生器,将酒精、氯化钠(NaCl)、过氧化氢( H2O2 )等气溶胶作为干扰物,通过荧光粒子占总粒子数的比例和归一化荧光的强度分布判断气溶胶是否含有生物粒子,从而研究荧光法生物气溶胶监测仪的抗干扰能力。
荧光法生物气溶胶监测仪抗干扰实验数据如表1 所示。
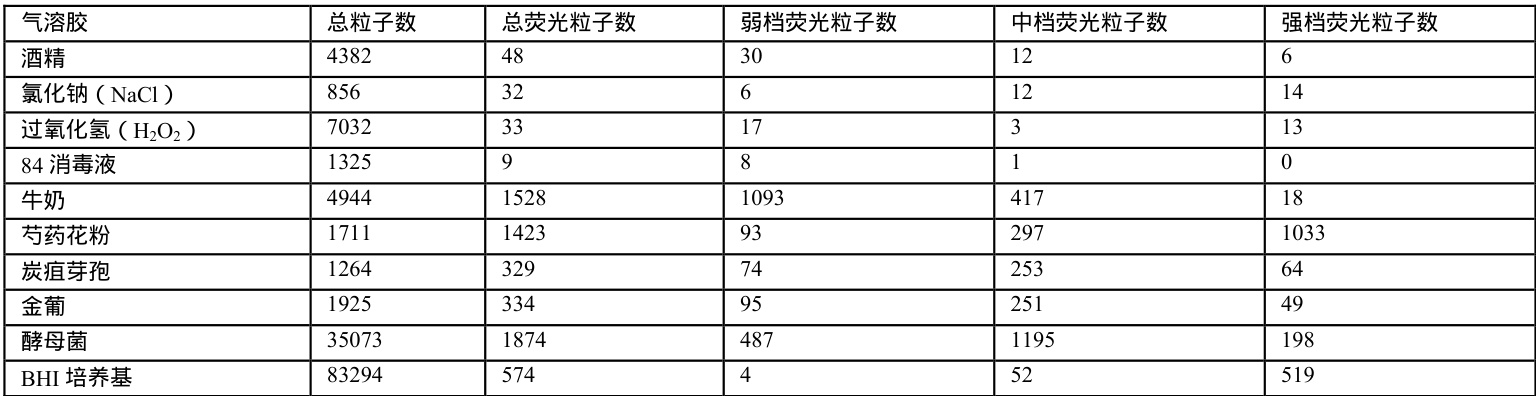
注:数值为在仪器周期6s,流量 2.83L/min 所测得颗粒数;结合表1,可以计算出各气溶胶的荧光粒子数在总粒子数中的占比、弱档荧光粒子数、中档荧光粒子数和强档荧光粒子数在总荧光粒子数中的所占比例;
如下表2
表2 荧光粒子数和各档位荧光粒子数占比
弱档荧光柱状图
强档荧光粒子
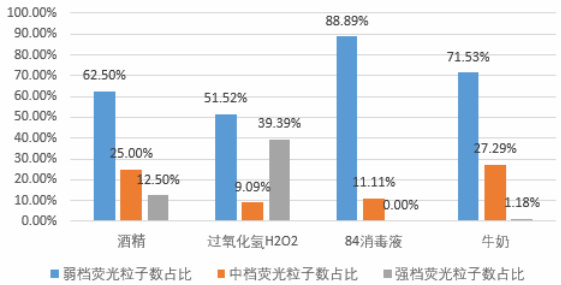
图4 弱、中、强档荧光粒子干扰物柱状图
分析图4、图5(柱状图)及表2 数据表明:
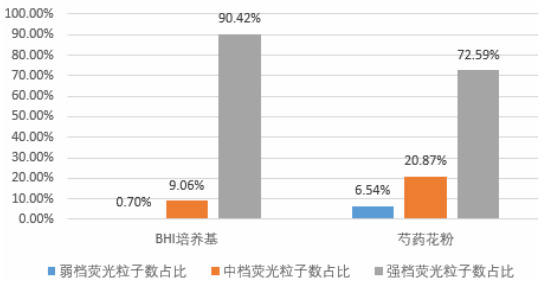
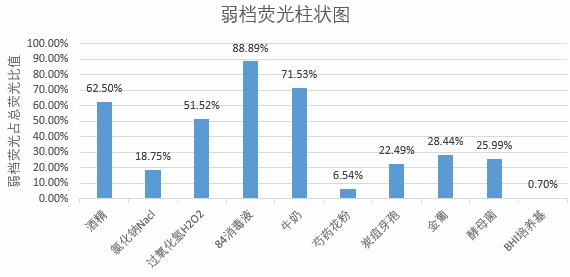
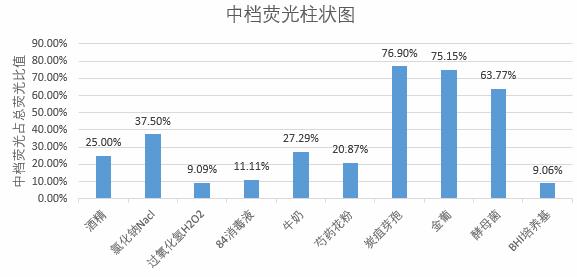
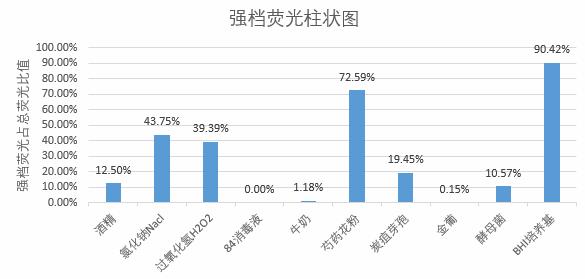
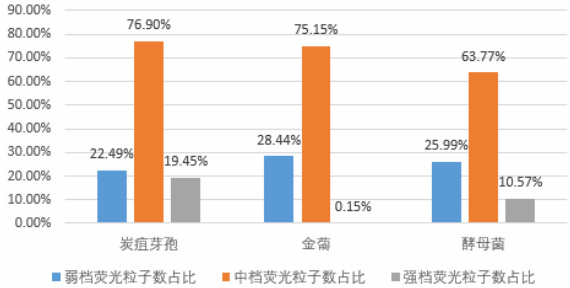
图5 弱、中、强档荧光粒子占总荧光粒子占比柱状图
酒精、过氧化氢( H2O2 )、84 消毒液、牛奶的荧光粒子主要分布在弱档(占比 550% )。
炭疽芽孢、金葡菌、酵母菌的荧光粒子主要分布在中档(占比 560% )。芍药花粉和 BHI 培养基属于强荧光物质,荧光主要分布在强档(占比570% )。
氯化钠(NaCl)的中档和强档荧光分布接近。
综合上述说明不同气溶胶粒子分布是不同的,我们根据这些数据根据抗干扰算法可以得到的生物粒子数。当生物粒子数超过报警阈值,界面显示报警状态。
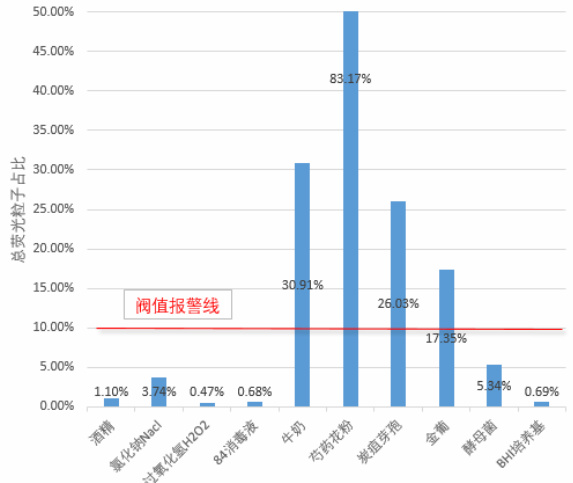
图 6(柱状图,略) 显示酒精、NaCl、 H2O2 、84 消毒液、酵母菌、BHI 培养基的总荧光粒子占比极低(均 <10% )。
基于以上显著差异,提出三重判据生物粒子识别算法:
总荧光粒子占比 >10% : 排除荧光粒子占比极低的干扰物(如酒精、过氧化氢( H2O2 )、84 消毒液、氯化钠( ΔNaCl )、酵母菌、BHI 培养基)。
弱档荧光粒子占比 >10% : 排除弱档占比极低的强荧光非生物粒子(如芍药花粉)。
强档荧光粒子占比 >20% : 排除强档占比较低的生物粒子(如炭疽芽孢、金葡菌)及弱档占比极低的BHI 培养基。同时满足以上三个条件时,判定为含有生物粒子。 该方法有效排除了实验中各类非生物粒子的干扰。
4 结论
本研究针对荧光法生物气溶胶监测仪在复杂环境中因非生物粒子交叉荧光导致高误报率的核心问题,在前期归一化本征荧光信号分类技术基础上,进行了系统性的抗干扰能力验证与模型优化。
拓展验证与特征揭示: 通过测试酒精、NaCl、 H2O2 、84 消毒液、牛奶、芍药花粉、BHI 培养基及多种生物粒子(炭疽芽孢、金葡菌、酵母菌),揭示了不同类别气溶胶在总荧光粒子占比及弱、中、强档归一化荧光分布比例上存在显著且规律的差异,形成了可区分的“ 荧光特征指纹” 。
创新三重判据算法: 基于特征差异,提出并验证了三重判据生物粒子识别算法(总荧光占比 510% ,弱档占比 >10% ,强档占比 520% )。该算法通过逻辑与关系协同作用:
510% 总荧光占比排除本身荧光粒子稀少的干扰物(如化学品、无机盐、部分培养基/酵母)。
>10% 弱档占比排除强荧光非生物粒子(如花粉)。
520% 强档占比排除强档荧光贡献低的生物粒子(如测试的细菌芽孢和球菌)及特定培养基(BHI)。
实验证明,该算法能有效区分本研究中的目标生物粒子与各类测试干扰物,显著降低了设备对这些非生物粒子的误报率。
局限性与未来方向: 本研究仍存在局限性:测试干扰物种类需进一步扩展至更复杂样本(如矿物粉尘、烟尘);未模拟实际环境中生物与非生物粒子混合共存场景;静态阈值在不同环境下的普适性有待验证;受控环境未充分考察温湿度等变量影响。未来工作将聚焦于:扩大样本库与混合场景测试;深化多维荧光特征解析(如荧光寿命、光谱形态、结合散射信息);开发智能动态阈值算法提升环境适应性;探索先进机器学习模型(如深度学习)提升复杂干扰下的泛化能力;开展长期现场验证评估实用性与稳定性。
5参考文献
[1] World Health Organization. Infection prevention and control of epidemic- and pandemic-prone acute respiratory infections in health care[R]. Geneva: WHO, 2021.
[2] DOUWES J, THORNE P, PEARCE N, et al. Bioaerosol health effects and exposure assessment: Progress and prospects[J]. Annals of Occupational Hygiene, 2003, 47(3): 187-200.
[3] HUFFMAN J A, PERRING A E, SAVAGE N J, et al. Real-time sensing of bioaerosols: Review and current perspectives[J]. Aerosol Science and Technology, 2020, 54(5): 465-495.
[4] PAN Y L, HOLLER S, CHANG R K, et al. Single-particle fluorescence spectrometer for ambient aerosols[J]. Aerosol Science and Technology, 2015, 49(11): 1133-1148.
[5] RUSKE S, TOBIN D J, GALLAGHER M, et al. Performance of bioaerosol samplers: Collection characteristics and sampler design considerations[J]. Atmospheric Environment, 2018, 182: 127-144.
[6] SAVAGE N J, KORTE A R, JACKSON S R, et al. Spectral intensity bioaerosol sensor (SIBS): A new instrument for spectrally resolved fluorescence detection of single particles[J]. Optics Express, 2017, 25(22): 26907-26914.
[7] ZHENG F, LI H, WANG X, et al. Machine learning-based classification of pollen species using single-particle fluorescence spectra[J]. Sensors and Actuators B: Chemical, 2019, 297: 126704.
[8] KISELEV D, BONACCESE F, FRANZKE J, et al. Simultaneous measurement of light scattering and fluorescence for single aerosol particles: A review[J]. Journal of Aerosol Science, 2021, 151: 105679.
[9] HEALY D A, O'CONNOR D J, BURKE A M, et al. A laboratory assessment of the Waveband Integrated Bioaerosol Sensor (WIBS-4) using individual samples of pollen and fungal spore material[J]. Atmospheric Environment, 2014, 92: 109-116.
[10] CHEN Q, LIU Y, ZHANG T, et al. Transfer learning for bioaerosol classification in fluorescence-based detectors under varying environmental conditions[J]. Analytical Chemistry, 2022, 94(15): 5890-5898.
[11] TOPRAK E, SCHNAITER M. Fluorescent biological aerosol particles measured with the Waveband Integrated Bioaerosol Sensor WIBS-4: Laboratory tests combined with a one year field study[J]. Atmospheric Chemistry and Physics, 2013, 13(1): 225-243.
[12]朱鑫琦,张佩,王光辉,等.基于归一化本征荧光信号的气溶胶分类技术研究[J].中国激光,2023,50(13)DOI:10.3788/CJL221427
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)