药物联合治疗肿瘤的协同效应及方案优化

陈建英 普艳蓉通讯作者
云南省肿瘤医院 昆明医科大学第三附属医院 北京大学肿瘤医院云南医院 药学部
引言:恶性肿瘤是全球范围内致死率最高的疾病之一。传统单药治疗存在疗效有限、易产生耐药、副作用大等问题。近年来,多药联合治疗策略因其在提高疗效、降低耐药性、延长生存期等方面的显著优势而成为研究热点,不同机制的药物之间可能存在协同或相加作用,从而增强整体抗肿瘤效应[1]。
1. 材料与方法
1.1 研究对象
选取 2022 年 1 月至 2024 年 6 月期间在我院肿瘤科接受治疗的恶性肿瘤患者共200 例作为研究对象。纳入标准为:经病理确诊为实体瘤(如肺癌、乳腺癌、结直肠癌等);年龄 18~75 岁;无严重心肝肾功能障碍;未接受过相关靶向或免疫治疗;签署知情同意书并能配合随访。排除标准包括:合并其他恶性肿瘤、妊娠期或哺乳期女性、对所用药物过敏者、失访或资料不全者。将 200 例患者按照治疗方案不同分为联合治疗组( n=100 )和单药治疗组( 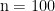 ),两组在性别、年龄、肿瘤类型、分期等方面比较差异无统计学意义( P>0.05 ),具有可比性。
),两组在性别、年龄、肿瘤类型、分期等方面比较差异无统计学意义( P>0.05 ),具有可比性。
1.2 研究方法
1.2.1 联合治疗组实施多靶点联合治疗策略,采用作用机制互补的 2 种及以上抗肿瘤药物组合:
(1)非小细胞肺癌亚组:实施三药联合方案,包括 PD-1 抑制剂帕博利珠单抗(每3 周静脉注射 200mg )、铂类化疗药物卡铂( AUC=5 ,第1 天静脉注射)以及紫杉醇( 175mg/m2 ,第1 天静脉注射)。
(2)晚期乳腺癌亚组:应用双靶向治疗策略,联合使用曲妥珠单抗(首次给药 8mg/kg 静脉注射,后续每 3 周 6mg/kg )、帕妥珠单抗(首次给药 840mg 静脉注射,后续每3 周 420mg )及化疗药物多西他赛( 75mg/m2 ,第1 天静脉注射) )
(3)结直肠癌亚组:采用标准化疗联合抗血管生成方案,药物组合为奥沙利铂( 130mg/m2 ,第 1 天静脉注射)、5- 氟尿嘧啶( 400mg/m2 静脉推注+2400mg/m2 持续静脉输注 46 小时)以及贝伐珠单抗(每 2 周静脉注射 5mg/ kg )[2]。
1.2.2 单药治疗组的治疗方案依据 NCCN 指南推荐,为各瘤种选用相应的标准治疗药物:
(1)非小细胞肺癌患者:接受培美曲塞治疗,剂量为 500mg/m2 ,每3 周静脉滴注一次。
(2)乳腺癌患者:应用白蛋白结合型紫杉醇,剂量为 260mg/m2 ,每3 周静脉滴注一次。
(3)结直肠癌患者:采用卡培他滨治疗,口服给药,剂量为 1000mg/m2 ,每日两次(bid),于每个 21 天周期的第 1 至 14 天服用(d1-14q3w)[3]。
1.3 疗效评估指标
1.3.1 建立四级疗效评估标准:
全缓解(CR):靶病灶全部消失且无新发病灶;
部分缓解(PR):靶病灶最大径总和减少 ⩾30% 疾病稳定(SD):未达PR 标准但无进展证据;
疾病进展(PD):靶病灶增大 ⩾20% 或出现新发病灶。
基 于 上 述 标 准 计 算 客 观 缓 解 率( ORR=CR+PR )、 疾 病 控 制 率(DCR=CR+PR+SD)。生存数据采集无进展生存期(PFS,从治疗开始至首次记录 PD 或任何原因死亡的时间)及总生存期(OS,治疗开始至任何原因死亡的时间)。毒性反应评价采用美国国立癌症研究所通用毒性标准(CTCAE5.0 版),重点监测Ⅲ- Ⅳ级不良事件发生率 [4]。
1.3.2 协同效应评价
采用 Chou-Talalay 法计算协同指数(CombinationIndex,CI):
CI<1 :表示协同作用;
CI=1 :表示相加作用;
CI>1 :表示拮抗作用。
1.4 统计学分析
所有数据采用 SPSS26.0 软件进行统计分析。计量资料以均数 ± 标准差( 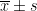 )表示,组间比较采用独立样本 t 检验;计数资料采用 χ2 检验,P<0.05 为差异有统计学意义。
)表示,组间比较采用独立样本 t 检验;计数资料采用 χ2 检验,P<0.05 为差异有统计学意义。
2. 结果
2.1 疗效比较
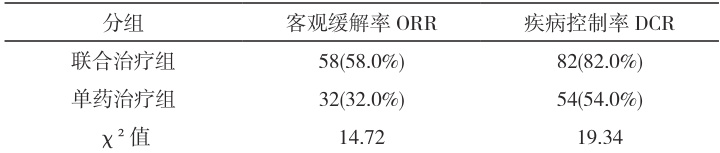
联合治疗组 ORR 为 58.0% (58/100),显著高于单药组的 32.0% (32/100)( χ2=14.72 , P<0.05 );DCR 分别为 82.0% 与 54.0% ,差异亦具统计学意义( P<0.05) 见表 1 。

2.2 生存分析
生存分析结果显示,联合治疗组患者中位无进展生存期(PFS)达9.6 个月,显著优于单药组的 5.3 个月(风险比 [HR]=0.54 , 95% 置信区间 [CI]0.41--0.71 ;统计显著性 P<0.05) 。在总生存期(OS)方面,联合治疗组中位OS 为22.5 个月,单药治疗组为 15.2 个月( HR=0.62 , 95%CI0.48-0.81 ; P<0.05 ),联合方案展现出明确的生存获益。
2.3 不良反应情况
治疗相关不良事件(TRAEs)分析表明,联合治疗组Ⅲ级及以上不良反应发生率为 38.0% ,显著高于单药组的 16.0% (卡方检验 χ2=11.26 , P<0.05) 联合组主要毒性谱包括:造血系统抑制( 15.0% )、消化道毒性如恶心呕吐( 10.0% )以及药物性肝损伤( 8.0% ),凸显多药联用带来的毒性叠加效应。
2.4 协同效应分析
采用 Chou-Talalay 定量模型进行协同指数(CombinationIndex,CI)计算,发现多数联合方案的CI 值持续低于临界值1.0(CI<1),证实存在药理学协同作用。
3 讨论
恶性肿瘤治疗领域,联合用药方案相较于单一药物治疗展现出明确的临床优势。本项研究通过严谨对比分析证实,药物组合策略在提升客观缓解率(ORR)、延长患者无进展生存期(PFS)以及总生存期(OS)方面成效显著,其临床应用价值获得有力支撑。协同效应机制的深入探讨进一步揭示,通过科学配伍作用机制互补的抗肿瘤药物,能够超越简单加和效应,达成“ 1+1>2 ”的增效目标。当前治疗格局下,分子靶向治疗药物及免疫检查点抑制剂 (ICI) 的持续涌现,极大丰富了联合策略的多样性。具体实践层面,诸如 PD-1/PD-L1抑制剂与 CTLA-4 抑制剂的组合疗法,已获得监管机构批准用于黑色素瘤及非小细胞肺癌(NSCLC)的治疗。在乳腺癌领域,针对 HER2 靶点的双靶向治疗模式显著改善了临床结局。同时,传统细胞毒性化疗药物与抗血管内皮生长因子(VEGF)等抗血管生成制剂的联合,已成为多种晚期实体瘤(如结直肠癌、卵巢癌等)一线治疗的基石方案。这些成功范例的根基,在于对药物间相互作用及增效原理的持续探索。然而,联合治疗路径并非坦途,面临多重现实挑战。首要障碍在于治疗相关毒性的累积效应,相当比例患者因难以承受叠加的不良反应而被迫中止治疗。其次,协同效应评判标准的统一性存在显著缺失,缺乏普适、量化的评估框架,无形中加大了临床决策的复杂性。尤为关键的是,个体化医疗需求日益凸显。如何精准整合患者的肿瘤基因突变谱、PD-L1 蛋白表达丰度、肿瘤微环境(TME)的异质性特征等关键生物标志物信息,从而筛选出最优化的个体联合用药方案,是未来研究亟待突破的核心方向。
综上所述,抗肿瘤药物联合应用凭借其协同增效潜力和广阔的临床前景,已成为重要的治疗范式。但要充分释放其效能,必须深度融合精准医学理念。未来需系统性地借助高通量生物标志物检测技术(如多组学分析、ctDNA 监测)、以及人工智能驱动的辅助决策工具等手段,持续优化治疗方案设计。核心目标是在显著提升治疗有效性的同时,严密管控安全性风险,最终实现真正意义上的、基于患者个体生物学特征的定制化治疗。
参考文献:
[1] 吴锋 , 王樱蕙 , 张洪杰 . 肿瘤微环境响应降解的智能纳米药物用于光动力 / 光热 / 气体联合治疗 [J]. 应用化学 ,2025,42(03):375-390.
[2] 李国明 , 李建红 , 吕建男 , 杨娜 , 王久洁 . 吉西他滨联合顺铂化学治疗方案治疗蒽环和紫杉类药物治疗后复发三阴性乳腺癌疗效观察 [J]. 新乡医学院学报 ,2024,41(12):1144-1148.
[3] 姜楠 , 沈健 , 朱晓黎 .TACE 联合靶向、免疫药物治疗肝细胞癌的研究进展 [J]. 现代肿瘤医学 ,1-6.
[4] 孟凡祺 . 用于结直肠癌联合治疗的纳米药物递送系统的设计与构建 [D].吉林大学 ,2024.
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)