OSAHS合并肺动脉高压患者炎性介质、内环境及多肽类分子表达研究

陈光喜 刘志强 雷梅先 杜丹丹
江西九江市 九江市第一人民医院 全科医学科 332000,江西九江市 九江市第一人民医院 心血管内科 332000,江西九江市 九江市第一人民医院 九江市九龙社区 332000
摘要:目的 探讨阻塞性睡眠呼吸暂停低通气综合征(OSAHS)合并肺动脉高压(PAH)患者的炎症介质、内环境及多肽类分子的表达水平,分析其与 OSAHS 患者的差异及机制,并评估双水平气道正压通气在该疾病的治疗效果。方法 本研究纳入 2024 年 1 月至 2024 年 12 月就诊于本院的 OSHAS 患者,按照肺动脉压值分组,分为 OSAHS 合并肺动脉高压组、单纯 OSAHS 组,飞别测定 T NF- α 、IL- 6、CR P、NT - pro- BNP、BMI、AHI、LaSO2,比较两组指标的差异,分析 OSAHS 合并肺动脉高压患者的临床特征及机制,并且通过双水平气道正压通气治疗后,再次检测相关指标,比较治疗前后指标的差异,从而分析总结 OSAHS 合并肺动脉高压患者的临床特征、相关机制及BiPAP在该疾病的治疗效果。结果 最终共纳入85例研究对象,OSAHS合并肺动脉高压为实验组(n=44),其中男性41例( 93.2% )女性3例( 6.8% ),平均年龄为(43.95± 1.76)岁;单纯OSAHS 组为对照组(n=41),其中男性36 例( 87.8% ),女性 5 例(12.2%),平均年龄为(46.44± 1.83)岁,实验组 T NF- α 、BMI、AHI 平均值分别为(8.52± 1.23)pg/mL、(33.70± 3.39)kg/m2、(66.32± 19.63)次 / 时,均明显高于对照组各值( 3.51±0.72 )pg/mL、(25.29± 2.48)kg/m2、(43.36± 16.62)次 / 时( P<0.001 );实验组 IL- 6、CR P、NT - pro- BNP、无创动脉血气均值分别为 9.44(9.02,10.36)mg/dL、1.53(1.3,2.31)mg/dL、81.96(39.34,85.35)pg/ml、56(52,59)mmHg 均高于对照组各项均值:4.52(4.12,5.13)mg/dL、0.34(0.23,0.48)mg/dL、20.12(12.14,25.38)pg/ml、32(29,35.5)mmHg( P<0.001 ),而 LSO2 水平在实验组为 70(60,79)低于对照组 77(67,83.5)( 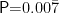 )。结论 OSAHS 合并PAH 患者较单纯OSAHS 患者存在显著炎症激活状态,表现为炎症因子T NF- α 、IL- 6、CR P 的升高、多肽类分子 NT - pro- BNP 的异常,且该类患者体重指数偏高,易合并有高碳酸血症的内环境紊乱,BiPAP 治疗能有效改善异常指标,值得临床推广应用。
)。结论 OSAHS 合并PAH 患者较单纯OSAHS 患者存在显著炎症激活状态,表现为炎症因子T NF- α 、IL- 6、CR P 的升高、多肽类分子 NT - pro- BNP 的异常,且该类患者体重指数偏高,易合并有高碳酸血症的内环境紊乱,BiPAP 治疗能有效改善异常指标,值得临床推广应用。
OSAHS 是在睡眠过程中上气道部分或完全塌陷导致呼吸暂停及低通气,引起间歇性缺氧、反复微觉醒,而导致的一系列的病理生理改变的综合征。中国患病人数最多,轻度以上约 1.76 亿,中度以上有 0.66 亿,已成为经济和社会负担[1]。目前,对于 OSAHS 与高血压、充血性心力衰竭、心律失常之间的联系有了深入的理解,但对 OSAHS 与肺动脉高压的研究资料较少,且多数资料是基于观察性研究。同时,OSAHS 与肺动脉高压的机制尚不明确,多数国外学者认为与缺氧、氧化应激、炎症因子相关 [2-3] 。高蔚等人 [4] 研究认为,中重度 OSAHS 患者易并发肺动脉高压,且BMI、夜间平均SPO2 、TST-A 为OSAHS 并肺动脉高压的独立危险因素。王绍金[5]通过观察性研究认为,炎性指标 TNF-α、IL-6、CRP与 OSAHS 相关肺动脉高压呈正相关性,AHI、LSaO2、TST 是 OSAHS 肺动脉高压的危险因素。NT-proBNP 在临床广泛应用在心衰中,近年相关研究表明 NT-proBNP 与肺动脉高压严重程度呈正相关,且能预测肺动脉高压患者的病死率[6],但其与 OSAHS 并肺动脉高压的相关研究较少。本研究通过监测 OSAHS 并肺动脉高压患者炎性介质、经皮动脉血气、多肽类分子的变化及睡眠监测相关参数,总结 OSAHS 并肺动脉高压患者临床特征,并给予其双水平气道正压通气治疗后进行比较分析,评估治疗效果,为今后该疾病机制的研究、疾病治疗提供理论基础及临床参考。
1 对象与方法
1.1 研究对象
前瞻性方法纳入 2024 年 1 月至 2024 年 12 月因鼾症就诊于本院进行 PSG 的成人患者,经 PSG 及彩超检查诊断为阻塞性睡眠呼吸暂停低通气综合症合并肺动脉高压作为实验组,单纯的阻塞性睡眠呼吸暂停低通气综合症作为对照组,所有患者均签订知情同意书。
纳入标准: 1、 20⩽ 年龄 ⩽80 岁;2、经过PSG 确诊,符合OSAHS 诊断标准。3、同意参与该研究。
排除标准 : 1、合并有左心功能不全、严重的肝肾疾病者 ; 2、既往有先天性肺动脉狭窄、肺动脉高压、急慢性气道及精神疾病等患者 ; 3、近 3 月有使用影响肺动脉高压的药物;4、中枢性、混合性睡眠呼吸暂停者。
1.2 研究方法
收集每位受试者的年龄、性别、BMI、PSG 监测(AHI、LSaO2)、肺动脉压、TNF-α、IL-6、CRP、NT-proBNP、无创动脉血气数值( (PaCO2, )。试验流程如下。
1.2.1 一般资料收集:收集受试者的年龄、性别,测量身高、体重,由体重、身高,计算出BMI 数值。
1.2.2 采血及相关血液化验:实验组及对照组在次日晨起后在右侧肘正中静脉采血,抽取空腹静脉血 8ml ,通过 ELISA 法进行 TNF- a 、IL-6、CRP、NT-Pro-BNP 测定。实验组在无创呼吸机BiPAP 治疗1 月后,由上述方法再次测定相关指标。
1.2.3 PSG 监测及结果判读:所有患者行整夜的多导睡眠监测 PSG,安装电极或探头,包括(脑电图电极、眼电图电极、口鼻气流热敏监测、胸腹带、指端血氧监测等),呼吸暂停判断依据为口鼻气流消失,或较基线下降 ⩾90% ,持续时间≥ 10S;低通气判断依据为鼻气流水平较基线下降 ⩾30% ,且伴有 SPO2 降低 ⩾3% 或伴觉醒,同时持续时间 ⩾10S 最后计算出 AHI,AHI ⩾5 次 /h 作为诊断 OSA 参考标准,轻度 :5 次 /h⩽AHI<15 次 /h ;中度 :15 次 /h⩽AHI<30 次 /h;重度 :AHI ⩾30 次 / 时。
1.2.4 经皮二氧化碳监测(TCPCO2):使用丹麦雷度公司型号为 TCM4 无创 PCO2 监测仪进行监测,取最高值作为最终数据,操作如下:TCPCO2 监测前先将仪器进行气体校正,然后将信号传输系统通过拓展通道整合到 PSG 系统,信号及数据可实现同步记录,以患者左前臂位置为体表标点,进行皮肤消毒后安置电极,在传感器膜片上涂抹电解质凝胶,确保与皮肤良好接触,将传感器加热到43℃,启动设备,观察监测曲线和数值。
1.2.5 心脏彩色多普勒检查:通过彩超多普勒,检测三尖瓣最大返流速度(VTR),由下腔静脉内径及其吸气末塌陷程度估测右房压,应用伯努利方程计算 PAP,PAP=4×V2TR + 右房压[7]。参考 2022ESC/ERS 指南平均肺动脉收缩压> 20mmHg 判定为肺动脉高压[8]。
1.3 统计学分析
使用SPSS 25 统计软件行数据分析,符合正态分布采用均数 ± 标准差表示,符合正态分布且方差齐的两组独立数据选择独立样本 T 检验。偏态数据选择中位数M(P25,P75)表示,组间比较采用非参数秩和检验;计数资料使用构成比表示,组间比较采用χ2 检验; P<0.05 认定差异有统计学意义。
2 结果
2.1 人口学资料
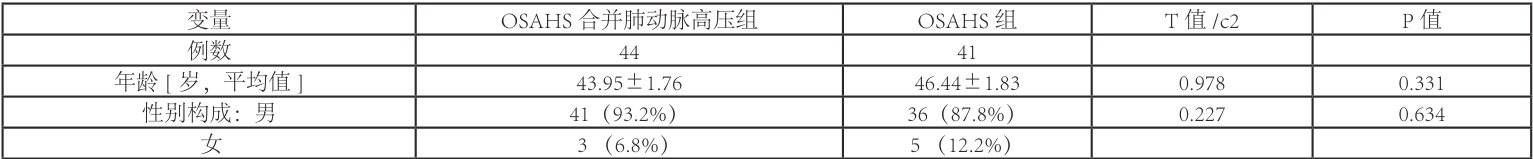
最终纳入85 例患者作为研究对象,OSAHS 合并肺动脉高压为实验组( 1=44 ),其中男性 41 人,占比 93.2% ,女性 3 人,占比 6.8% ,年龄在 25-66 周岁之间,平均年龄为(43.95±1.76)岁;单纯OSAHS组为对照组( (n=41) )其中男性36例( (87.8%) ),女性 5 例( (12.2%) ),年龄在 25-68 周岁之间,平均年龄为(46.44±1.83)岁,两组数据在年龄及性别构成比基线一致,P 值分别为0.331、0.634,详细比较见表1。
表1 患者人口学特征在OSAHS 合并肺动脉高压组和OSAHS 组的比较
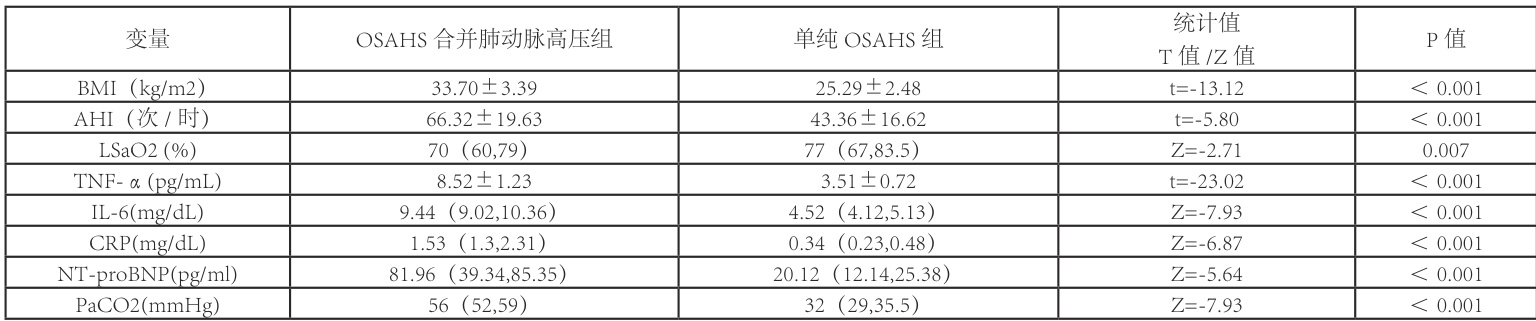
2.2 BMI、AHI、LSaO2、TNF- α 、IL-6、CRP、NT-proBNP、无创动脉血气数值( ΦPaCO2 )各项指标OSAHS 合并肺动脉高压组在 BMI、AHI、TNF- a 、IL-6、CRP、NT-proBNP及 PaCO2 数值上均高于单纯 OSAHS 组,两者具有统计学意义( P<0.001 );而在 LSaO2 指标中,OSAHS 合并肺动脉高压组低于单纯 OSAHS 组,两者具有统计学意义( P=0.007) ),各指标详细数值及组间比较见表2。
表2 各观察指标在OSAHS 合并肺动脉高压组和OSAHS 组的比较
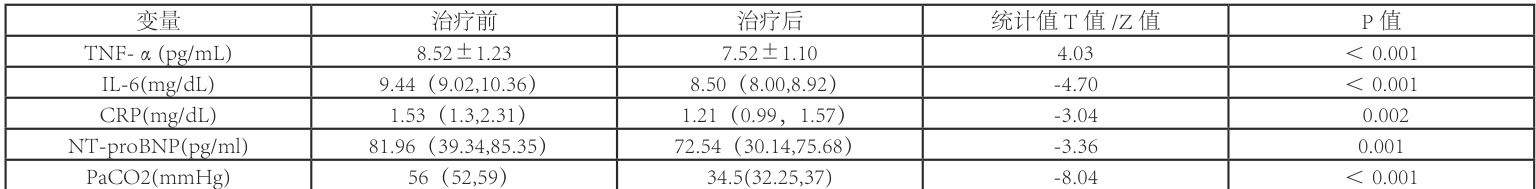
2.3 OSAHS 合并肺动脉高压在 BiPAP 治疗 1 月后,各项指标前后情况及组间比较观察组 44 例诊断 OSAHS 合并肺动脉高压患者经 BiPAP 治疗 1 月后,血TNF- a 平均值为 7.52±1.10pg/mL ,较治疗前平均值 8.52±1.23pg/mL 下降,差异具有统计学意义( P<0.001 );血 IL-6 水平治疗后为 8.50(8.00,8.92) mg/dL ,较治疗前 9.44(9.02,10.36)mg/dL 下降,差异具有统计学意义(  );血CRP 治疗后平均水平为 1.21(0.99,1.57) mg/dL ,较治疗前平均水平 1.53(1.3,2.31)mg/dL 下降,差异具有统计学意义( P=0.002⋅ );血 NT-proBNP 治疗后平均水平为 72.54 (30.14,75.68) pg/ml , 较 治 疗 前 平 均 水 平 81.96 (39.34,85.35)
);血CRP 治疗后平均水平为 1.21(0.99,1.57) mg/dL ,较治疗前平均水平 1.53(1.3,2.31)mg/dL 下降,差异具有统计学意义( P=0.002⋅ );血 NT-proBNP 治疗后平均水平为 72.54 (30.14,75.68) pg/ml , 较 治 疗 前 平 均 水 平 81.96 (39.34,85.35) 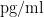 下
下
降,差异具有统计学差异( P=0.002) ; 同时无创动脉血气 PaCO2 治疗后平均水平为 34.5(32.25,37)mmHg ,较治疗前水平 56(52,59) mmHg 下降,治疗前后差异具有统计学意义( ΦP<0.001 )。治疗前后各指标数值及前后比较见表3
表3 各观察指标在OSAHS 合并肺动脉高压组BiPAP 治疗前后的比较
3 讨论
目前关于阻塞性睡眠呼吸暂停低通气综合征并发肺动脉高压的具体机制尚未完全明确,但已有研究揭示了多种可能的病理生理途径,包括间歇性缺氧与氧化应激、炎症反应与内环境失衡、内皮功能障碍、合并症及遗传因素等。
本研究通过前瞻性对照研究揭示了 OSAHS 合并 PAH 患者相较于单纯OSAHS 患者存在显著的炎症激活、代谢紊乱、内环境紊乱及心血管应激特征。实验组 TNF- a 、IL-6、CRP 等炎症因子显著升高,与文献[9]报道的 OSA 患者全身性炎症状态形成机制相印证。值得注意的是,实验组 NT-pro-BNP 中位数达到 81.96pg/mL ,较对照组升高约 4 倍,这与文献[10]提出的 NT-pro-BNP 作为 PAH 患者右心功能受损和心血管事件预测指标的作用高度一致,提示 OSAHS合并 PAH 患者已出现明显的右心室压力负荷增加,该多肽类分子未来可能成为OSAHS 合并肺动脉高压一重要生物标志物。
从病理生理机制角度分析,实验组 BMI 和 AHI 显著增高,与文献 [11] 揭示的肥胖与 OSAHS 严重程度间的恶性循环机制相契合。高 BMI 不仅通过机械性压迫加重上气道塌陷,同时脂肪组织分泌的炎症因子可能直接参与肺动脉重构[9]。而 AHI 的显著差异提示更严重的间歇性缺氧可能通过激活 NF-κB 通路,刺激TNF-α、IL-6 等促炎因子释放, 进而促进肺血管内皮功能障碍和血管重构。
在血气分析方面,实验组 LaSO2 的降低与动脉血二氧化碳分压升高形成鲜明对比,符合文献 [12] 提出的肥胖低通气综合征特征。这种高碳酸血症的持续存在可能通过酸中毒环境加剧肺动脉收缩,并与文献[10]报道的 NT-pro-BNP 水平动态变化机制相关联,形成“缺氧 - 炎症 - 血管重构”的恶性循环的微环境。TcCO2 监测在无创性、连续性方面具有显著优势,尤其适用于动态监测和特殊患者群体。TcCO₂ 有望在更多场景中替代动脉血气分析[13]。BiPAP 治疗后的指标改善具有重要临床意义。治疗后炎症因子和NT-pro-BNP 的显著下降,与文献[12]报道的BiPAP 通过改善肺泡通气、降低呼吸肌做功、纠正夜间低氧的机制相吻合。特别是 NT-pro-BNP 的下降幅度,与文献 ⌊10⌋ 提出的该指标对治疗反应的敏感性特征相符。这种改善可能源于BiPAP 治疗打破“缺氧- 炎症”恶性循环。
本研究的创新性在于从多个维度揭示 OSAHS 合并 PAH 患者的特异性生物标志物谱,选用无创动脉血气取代传统的采血动脉血气,避免了多次穿刺,规避了外界刺激干扰受试者的自然睡眠状态,所得结果真实可靠。同时,该研究存在以下局限性:对肺动脉压的监测未能选择右心导管术进行测量,故难以精确测量出肺动脉精确数值。未来研究可结合右心导管检查明确肺动脉压力梯度,从基因层面进一步探索宿主如何调控炎症介质、特异性损伤血管内皮程度及破坏内环境稳态,更深入地研究疾病的机制,同时开拓相关靶向治疗方案,从而提高远期获益。
参考文献
[1]Benjafield AV, Ayas NT, Eastwood PR, et al. Estimation of the global prevalence and burden of obstructive sleep apnoea: a literaturebased analysis [J].Lancet Respir Med,2019, 7(8):687-698.
[2]Iturriaga R, Castillo‐Galán S. Potential contribution of carotid body‐induced sympathetic and renin ⋅ angiotensin system overflow to pulmonary hypertension in intermittent hypoxia[J]. Curr Hypertens Rep, 2019,21(11):89.
[3] Wong HS, Williams AJ, Mok Y. The relationship between pulmonary hypertension and obstructive sleep apnea[J]. Curr Opin Pulm Med, 2017,23(6):517‐521.
[4]高蔚 , 肖永龙 , 翁婷 , 等 .OSAHS 并肺动脉高压的危险因素分析 [J].山东医药 ,2014,54(39):53-55.
[5]王绍金 . 炎症因子与 OSAHS 肺动脉高压的相关性研究[D]. 宁夏医科大学 ,2015.
[6] Hori Y, Uchide T, Saitoh R, Thoei D, Uchida M, Yoshioka K, Chikazawa S, Hoshi F. Diagnostic utility of NT-proBNP and ANP in a canine model of chronic embolic pulmonary hypertension. Vet J. 2012 Nov;194(2):215-21.
[7]Chan KL, Currie PJ, Seward JB, Hagler DJ, Mair DD, Tajik AJ. Comparison of three Doppler ultrasound methods in the prediction of pulmonary artery pressure.J Am Coll Cardiol. 1987;9(3):549-554.
[8]Humbert M, Kovacs G, Hoeper MM, et al. 2022 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension [published correction appears in Eur Heart J. 2023 Apr 17;44(15):1312.
[9]Fiedorczuk P, Olszewska E, Polecka A, Walasek M, Mroczko B, Kulczyńska-Przybik A. Investigating the Role of Serum and Plasma IL6, IL-8, IL-10, TNF-alpha, CRP, and S100B Concentrations in Obstructive Sleep Apnea Diagnosis. Int J Mol Sci. 2023;24(18):13875.
[10]Aetou M, Wahab L, Dreher M, Daher A. Significance of Hypocapnia in the Risk Assessment of Patients with Pulmonary Hypertension. J Clin Med. 2023;12(19):6307.
[11]He J, Wang C, Li W. Laryngopharyngeal Reflux in Obstructive Sleep Apnea-Hypopnea Syndrome: An Updated Meta-Analysis. Nat Sci Sleep. 2022;14:2189-2201.
[12]Paranicova I, Bodnarova S, Trojova I, et al. Long-term myocardial effects of noninvasive ventilation in patients with obesity hypoventilation syndrome. Respir Med. 2024;231:107735.
[13] Tufan TB, Rhein L, Guler U. Implementation Techniques for Transcutaneous Carbon Dioxide Monitoring: Approaches for Wearable Smart Health Applications. IEEE Trans Biomed Eng. 2024;71(3):929-943.
基金项目:江西省九江市科技局重点研究计划基金项目(S2023ZDYFN632)
作者简介:陈光喜(1983- ),男,汉族,江西九江人,医学硕士,主治医师,从事睡眠呼吸疾病的研究。
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)