肉牛腐蹄病的病原微生物分离及针对性防控措施研究

纳洪旗
永宁县动物疾病预防控制中心
0 引言
畜牧业发展以来肉牛养殖规模不断扩大,蹄部健康问题逐渐成为影响养殖效益的重要因素,其中腐蹄病作为一种由多种病原微生物引起的慢性蹄部疾病发病率高、传播快、复发性强,严重威胁肉牛健康与生产性能。该病多发生于潮湿、不洁或通风不良的养殖环境,临床上有蹄部红肿、腐败及明显的跛行表现,患病后牛群采食量下降、生长速度减缓、繁殖力下降,很容易给养殖户带来巨大的经济损失。
1 肉牛腐蹄病概述
肉牛腐蹄病是肉牛养殖最常见、最具危害性的蹄部疾病之一,通常发生于牛蹄的趾间或蹄底部位,以局部组织红肿、溃烂、疼痛和腐败为主要临床表现。患病牛只多有步态不稳、行动迟缓的表现, ju 重时出现明显跛行甚至卧地不起,影响正常采食,使生长发育迟缓、产肉性能降低。该病不仅危及单个牛只的健康,还常在牛群中呈现群体性流行,给养殖业带来明显经济损失。据国内外流行病学调查,腐蹄病的发病率在规模化养殖场可达 20%~30% ,管理不善或环境潮湿的地区甚至更高[1]。
从病因学角度看,肉牛腐蹄病的发生是多因素综合作用的结果,环境方面,牛舍通风不良、垫料潮湿、地面不平整或粪尿堆积都会让病牛蹄部长期处于潮湿污染状态,增加蹄部损伤和病原侵入的机会。而微量元素缺乏(如锌、硒、铜等)和维生素不足也会削弱蹄部角质组织的强度和修复能力,从而增加发病风险。病原学方面,研究表明,腐蹄病一般由多种厌氧菌和兼性厌氧菌的混合感染引起,主要包括腐蹄杆菌、梭状芽孢杆菌、拟杆菌属以及其他条件致病菌。这些微生物可以通过受损的皮肤或蹄部角质层侵入组织,产生毒素和酶类,使局部组织坏死或腐败。
2 肉牛腐蹄病的病原微生物分离方法
2.1 样本采集处理方法
肉牛腐蹄病病原微生物分离时,必须严格按照无菌原则进行样本采集,以保证分离结果准确性。操作流程如下:
(1)病牛选择。选择临床症状明显的个体,重点观察有蹄部溃烂、渗出脓液、跛行严重的牛只。采样前需固定病牛,用牛架或绳索限制行动,以避免采样时牛只挣扎产生污染或损伤。
(2)蹄部清理与消毒。用清水冲洗蹄部表面,去除泥土、粪便等杂质。再用 70% 酒精或 0.1% 碘伏棉球擦拭采样部位,范围覆盖病灶周围 3~5 cm。待自然干燥后开始取样。
(3)采样方法:先使用无菌注射器或拭子直接抽取或涂抹病灶渗出物,立即置入无菌试管或采样管,之后用无菌手术刀片或刮勺刮取腐败或坏死组织约 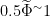 g,放入预装厌氧运输培养基的试管。溃疡较深的病灶可在表层组织消毒后,用无菌镊子和刀片取少量深层组织块,避免表层污染菌干扰。
g,放入预装厌氧运输培养基的试管。溃疡较深的病灶可在表层组织消毒后,用无菌镊子和刀片取少量深层组织块,避免表层污染菌干扰。
(4)样本保存运输。所有样品需立即封管并贴上编号。若为厌氧菌研究,推荐置于改良Cary-Blair 培养基或厌氧运输管中保存。运输时保持低温(4℃),并在 24 h 内送至实验室。若需长时间保存,可加入 15% 甘油后置于 -80℃ 冷冻保存[2]。
(5)实验室处理。先低速离心(3000 rpm,10 min),弃上清,取沉淀接种于培养基。使用无菌剪刀或研钵研磨匀浆,加入无菌 PBS 悬浮液制成均匀匀浆,再行接种。厌氧条件下的血琼脂培养基、选择性培养基(如 Kanamycin-Vancomycin aked lood gar, VLB)划线分离,37℃ 培养 24~48 ,观察菌落生长情况。
(6)避免污染与交叉感染。每采集一个样本后需更换一次性采样工具,并将不同牛只的样品分批处理,操作台需定时消毒,防止交叉污染。
2.2 病原菌培养与分离
获得样本后,需要尽快在实验室内进行病原菌培养。操作步骤如下:
(1)培养基准备。依据肉牛腐蹄病常见病原的特性,需同时准备多种培养基。常用培养基包括:厌氧血琼脂培养基(Blood Agar, BA),适用于多种厌氧菌的初步分离;巧克力琼脂,利于部分营养要求较高的细菌生长;改良 KVLB 培养基,用于选择性分离梭状芽孢杆菌及腐蹄杆菌;麦康凯培养基,用于鉴别是否存在革兰阴性杆菌。培养基接种前需提前恢复至室温,并置于厌氧罐或厌氧袋内预还原至少 30 分钟,以保留厌氧条件。
(2)样本接种。如果已经取得分泌物样本,可以用无菌接种环取少量沉淀物,在血琼脂平板上进行多区划线,保证获得单菌落。或取 100 μL 匀浆液,涂布于不同培养基表面,采用稀释法梯度接种。深层组织块可直接压碎或研磨后,将悬液滴加于平板中央,再进行划线。
(3)培养条件。接种后的平板立即置于厌氧培养系统(如 GasPak 罐或厌氧培养箱),37℃ 培养 24~72 h。部分平板可在常规有氧条件下培养,以便区分混合菌群。培养时需定时观察菌落生长情况,记录菌落形态、大小、色泽和气味等特征[3]。
(4)菌落挑选与纯化。培养 24 h 后,若有不同形态的菌落出现,应使用无菌接种环挑取单个菌落,转接至新的血琼脂或选择性培养基上,重复划线分离 2~3 次,直至获得单一菌株。纯化后的菌株需分别编号保存。
(5)初步鉴定。分离到的纯菌落进行革兰染色,显微镜下观察菌体形态、排列方式及染色反应。常见腐蹄病病原多为革兰阴性杆菌或梭状芽孢杆菌。必要时进行过氧化氢酶试验、氧化酶试验等基础生化反应,以便初步分类。
(6)菌株保存。纯化后的菌株需长期保存。常用方法包括:短期保存:4℃ 冰箱内血琼脂斜面培养基保存 2~4 周。长期保存:制备菌悬液,加入 15% 甘油后置于 -80℃ 冷冻保存。
(7)质量控制。整个培养分离流程要设置空白对照和标准菌株平板,以监测操作是否存在污染或偏差。每批实验均需记录操作步骤、培养条件和结果,以确保可追溯性。
2.3 鉴定技术
完成病原菌的培养分离后,需要通过多种方法系统鉴定所获得的纯菌株,以确定种属及致病特点,一般会使用形态学观察、生化反应试验以及分子生物学检测方法进行鉴定。
(1)形态学鉴定。革兰染色:将纯化后的菌落制备成涂片,使用标准革兰染色步骤(结晶紫-碘液-酒精脱色-复染液)处理,显微镜下观察菌体的形态、排列方式和革兰染色反应。腐蹄病相关的Fusobacterium necrophorum 多呈革兰阴性细长杆状,梭状芽孢杆菌呈革兰阳性粗大杆菌。镜检:除细胞形态外,还可观察芽孢、鞭毛、荚膜的有无。荚膜染色和鞭毛染色能辅助判断菌株的致病性。
菌落特征:不同培养基上的菌落颜色、边缘形态、气味均可作为初步鉴定依据,如腐蹄杆菌在血琼脂上常产生明显 β-溶血环[4]。
(2)生化鉴定。为进一步确定细菌种属,需要进行一系列生化反应:糖类发酵试验:接种于葡萄糖、乳糖、麦芽糖等含指示剂的培养基中,观察是否产酸或产气;酶学试验:如过氧化氢酶、氧化酶、脲酶、明胶液化试验等,能区分不同细菌;还原与分解能力:如硝酸盐还原试验、蛋白酶活性检测等可辅助判断细菌代谢特征。
(3)分子生物学鉴定。选取 16S rRNA 基因或特异性毒力基因作为靶标,提取细菌基因组 DNA,进行 PCR 扩增,产物电泳检测阳性条带;之后进行对 16S rRNA 基因扩增片段测序,将序列提交至NCBI BLAST 比对数据库,确定与已知菌株的同源性。若怀疑存在混合感染,可采用多重 PCR 技术同时检测不同病原菌的特异基因。
(4)耐药性与致病性辅助检测。为了指导防治措施,还可在鉴定后进行 药敏实验(如纸片扩散法、微量肉汤稀释法)评估菌株的耐药性谱。
3 肉牛腐蹄病针对性防控措施
3.1 药物防治
(1)局部处理与用药。治疗前需要将病牛固定在牛架或靠栏,保证操作安全。蹄部先用清水或高压水枪冲洗,彻底去除泥土和粪便。随后用 2%~3% 过氧化氢溶液冲洗病灶,待泡沫反应结束后再用 0.1% 高锰酸钾溶液或 0.5% 碘伏进行二次清洗。存在坏死组织或腐败层的蹄部可使用无菌刀片或刮匙去除坏死物,直至暴露出肉芽组织。局部处理结束后将四环素软膏、氯霉素软膏或复方碘酊均匀涂抹在创面上,再用无菌纱布覆盖并用绷带包扎。若条件允许可套上橡胶蹄套,既能保证药效持续时间,又能减少二次污染情况。局部处理一般每日一次,连续三到五天,直至渗出物减少、肉芽组织新生。
(2)全身抗菌治疗。中度及以上病例需要联合全身给药。常用方案包括:土霉素 10mg/kg 体重,肌肉注射,每日一次,连续 3~5 天;青霉素钠 2 万 IU/kg 体重,肌肉注射,每日两次,疗程5 天;头孢噻呋钠 1 mg/kg 体重,皮下注射,每日一次,疗程 3 天。伴随高热或深部感染的个体可选用氟苯尼考 20mg/kg 体重肌肉注射,每隔 48 小时一次,连续两次即可。
(3)联合用药与耐药控制。混合感染情况下,可用青霉素与链霉素联合的治疗方案,青霉素 2 万IU/kg 与链霉素 10mg/kg 同时肌注,疗程 3~5 天,可增强杀菌范围。若单一药物疗效不佳,可更换或联合使用不同机制的抗菌药物,避免长期使用同一种抗生素,防止耐药株积累。大规模牛群可定期抽样检测病原菌耐药谱,指导用药[5]。
(4)辅助疗法。疼痛明显的牛只可注射氟尼辛葡甲胺 1.1mg/kg 体重,静脉给药,每日一次,连用 3 天,以减轻炎症反应。恢复期牛只可在日粮中补充硫酸锌 60-80mg/kg 干物质、硒酵母 0.3mg/kg 干物质以及维生素 E 100 IU/kg 饲料,促进蹄角质组织修复。若牛只体况消瘦,还需添加高能量日粮和优质蛋白以提高免疫力。
(5)注意事项。药物治疗期间应保持牛舍环境干燥,地面及时清除粪便并铺设干燥垫料。局部包扎每日更换,避免药液稀释或污染失效。使用抗菌药物时必须遵循休药期要求,例如青霉素停药期7 天,头孢噻呋 4 天,氟苯尼考 28 天,以保证肉品安全。严重坏死或多次复发的个体可在局部麻醉下行外科刮治或部分蹄壳切除,若病情仍无改善,应考虑淘汰。
3.2 疫苗研发与免疫预防
(1)候选菌株选择制备。临床常见的腐蹄病相关菌株有腐蹄杆菌、梭状芽孢杆菌以及拟杆菌属。制备时一般会从病灶样本中分离出优势菌株,通过生化和分子学鉴定确认种属,再挑选致病性强且免疫原性较高的菌株作为候选。
(2)免疫程序设计。常见免疫程序为犊牛 6 月龄时进行首免,间隔 3~4 周后加强免疫一次;成年牛疾病流行季节前 1~2 个月进行基础免疫,每年定期加强一次。高风险牛群可在首免后每 6 个月追加一次,以使群体免疫力维持在较高水平。每头牛注射剂量一般为 2~3 mL,具体剂量需结合疫苗说明和牛只体重适当调整。
(3)免疫效果评价。疫苗接种后需要通过血清学方法检测抗体水平,以评价免疫效果。常用 ELISA或间接免疫荧光法测定特异性抗体滴度,通过追踪观察免疫牛群的发病率、病程和康复速度进行综合评估。
(4)免疫预防与综合措施。单纯依靠疫苗不能完全杜绝腐蹄病,所以免疫治疗时还应结合环境管理和营养调控措施。
3.3 环境管理
(1)牛舍结构与通风。舍内可以安装通风窗或机械通风设备,保证空气流通,避免长期高湿环境。大规模养殖场建议在牛舍顶部安装排气扇或采用开放式牛舍结构,以降低氨气和硫化氢浓度,减少蹄部皮肤和角质层受刺激的机会。
(2)垫料管理与清洁。牛舍内要用稻壳、木屑或沙子作为垫料,每日定时更换或翻动,保持干燥清洁。泌乳牛或舍饲育肥牛群可采用沙质垫料,既能减少蹄部损伤,又便于清理。牛舍内的粪便至少每日清理一次,雨季或湿度较高时期增加清理频率,结合喷洒石灰粉或过氧乙酸进行环境消毒。
(3)运动场与放牧区改良。长期在湿滑泥地或积水草地活动的牛群更容易发生腐蹄病,运动场应铺设碎石、沙砾或橡胶垫。放牧场地需保持适度轮牧,避免长期踩踏造成草场板结和积水。低洼地块应修建排水沟渠,防止雨季积水。
(4)饮水与饲喂区管理。饮水区和饲槽前是牛群最容易形成湿滑环境的区域,可以设置排水沟并定期冲洗。饮水器高度需适宜,避免牛只频繁将蹄部浸泡在水中。饲槽前地面可铺设防滑垫或硬化处理,以减少蹄部损伤和继发感染的机会。
(5)蹄浴与预防性处理。规模化养殖场常用溶液为 2%~5% 硫酸铜或 2%~3% 福尔马林进行蹄浴。蹄浴池长度需不少于 3 米,深度 10~15 厘米,让牛只蹄部完全浸没。牛群每周进行 1~2 次蹄浴,雨季可增加至 3 次。蹄浴后应及时更换药液,避免污染。
(6)蹄部定期修整。每年春秋各修蹄一次,高发区可增加至三次。修蹄时应修去过长、变形或嵌入异物的蹄壳,并保持前后蹄平衡。修蹄后的牛只可进行蹄浴或局部消毒,以降低继发感染风险。
结论:总而言之,肉牛养殖期间可能产生的疾病类型较多,腐蹄病就是其中一种较为常见的蹄部疾病类型,该病会侵蚀、损害肉牛的正常行动能力,逐渐影响肉牛正常生产、进食,有较强的破坏作用。为应对该疾病,必须通过微生物分离方法做好病况鉴定,并据此制定好针对性防控措施,改善肉牛生存状况。
参考文献:
[1]王林焕.牛腐蹄病病因及防控措施[J].世界热带农业信息,2025,(04):73-75.
[2]李三吓.肉牛腐蹄病的发生及综合防治[J].畜牧兽医科技信息,2024,(02):141-142.
[3]王银香.牛羊常见传染病类型及预防策略[J].中国畜禽种业,2022,18(07):141-142.
[4]赵丽君.牛腐蹄病流行情况及防治[J].畜牧兽医科学(电子版),2022,(08):78-79.
[5]王汉刚.牛腐蹄病病因及综合防治[J].中国动物保健,2022,24(04):43+68.
作者简介:
纳洪旗(1967.03.13——),男,回族,籍贯:宁夏,职称:高级兽医师,学历:大学本科,研究方向:畜牧、兽医。
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)