仔猪腹泻常见致病菌分离鉴定及药敏试验应用研究

阿洛嘉华
身份证号码:511133199312173256
引言
仔猪腹泻是养殖业中困扰养殖户的常见问题,不仅会导致仔猪生长迟缓,还可能提高死亡率,给养殖业带来显著的经济损失。在引发仔猪腹泻的诸多因素中,致病菌感染占据重要地位。由于不同地域、不同养殖环境下,致病菌的种类以及其耐药性存在差异,使得防治工作难以形成统一有效的方案。当前,虽有不少关于仔猪腹泻致病菌的研究,但在系统整合分离鉴定与药敏试验应用方面仍有不足。
一、仔猪腹泻常见致病菌的分离与鉴定
1.1 仔猪腹泻样本的采集与预处理方法
仔猪腹泻样本的采集需遵循无菌操作原则,以保证后续分离鉴定的准确性。本次研究选择发病仔猪的新鲜粪便作为主要样本,采集时使用灭菌的离心管,避免样本受到外界环境中微生物的污染。对于处于不同发病阶段的仔猪,分别采集了样本,以全面反映致病菌的情况。采集后的样本立即进行预处理,具体操作如下:称取 1g 粪便样本放入含有 9mL 无菌生理盐水的灭菌试管中,用振荡器充分振荡5 分钟,制成1:10 的混悬液;然后取1mL 上述混悬液放入含有 9mL 无菌生理盐水的灭菌试管中,制成1:100的混悬液,以此类推进行梯度稀释,直至得到1:1000 的混悬液。将各浓度的混悬液分别放入离心管中,以 3000r/min 的转速离心 10 分钟,取上清液作为后续分离培养的菌液,通过此操作去除杂质和较大的颗粒物质,获得较为纯净的菌液。
1.2 致病菌的分离培养与纯化技术
致病菌的分离培养根据可能存在的致病菌种类选择了合适的培养基。本次试验中,针对革兰氏阴性菌选用麦康凯培养基,针对链球菌等选用血琼脂培养基。将预处理后不同浓度的菌液分别接种到相应的培养基上,每个浓度接种3 个平板,然后将接种后的培养基放入 37∘C 、相对湿度 70% 的培养箱中培养 24-48 小时。培养结束后,观察培养基上菌落的形态特征,如大小、形状、颜色、边缘状态等,初步筛选出可疑致病菌菌落。对可疑菌落进行纯化培养,采用划线分离法,具体为:用灭菌接种环挑取可疑菌落,在新的培养基上进行连续划线,划线时每次划线前都要将接种环灼烧灭菌并冷却。将划线后的培养基放入 37∘C 、相对湿度 70% 的培养箱中培养24 小时,重复上述划线操作 3-4 次,直至获得单一、纯净的菌落,确保后续鉴定结果的可靠性。
1.3 基于分子生物学的致病菌鉴定方法
基于分子生物学的鉴定方法具有准确性高、特异性强的特点,在致病菌鉴定中应用广泛。本次研究采用聚合酶链反应(PCR)技术和基因测序技术进行鉴定。PCR 技术操作如下:提取纯化后菌落的基因组DNA,使用针对常见致病菌(如大肠杆菌、沙门氏菌、链球菌等)的特异性引物进行PCR 扩增。PCR 反应体系为 25μL ,其中包括 12.5μLPCRMix,上下游引物各 1μL ,模板 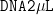 ,无菌去离子水 8.5μL 。反应条件为: 94∘C 预变性5分钟; 94∘C 变性30 秒, 55°C 退火30 秒, 72∘C 延伸1 分钟,共35 个循环;最后 72∘C 延伸 10 分钟。扩增完成后,通过琼脂糖凝胶电泳检测扩增产物的大小,与已知标准菌株的基因片段进行比对,从而确定致病菌的种类。此外,对PCR 扩增得到的阳性产物进行基因测序,将测序结果与基因数据库(如 GenBank)中的序列进行同源性分析,根据同源性的高低判断致病菌的种属,同源性在 97% 以上的判定为同一种属。
,无菌去离子水 8.5μL 。反应条件为: 94∘C 预变性5分钟; 94∘C 变性30 秒, 55°C 退火30 秒, 72∘C 延伸1 分钟,共35 个循环;最后 72∘C 延伸 10 分钟。扩增完成后,通过琼脂糖凝胶电泳检测扩增产物的大小,与已知标准菌株的基因片段进行比对,从而确定致病菌的种类。此外,对PCR 扩增得到的阳性产物进行基因测序,将测序结果与基因数据库(如 GenBank)中的序列进行同源性分析,根据同源性的高低判断致病菌的种属,同源性在 97% 以上的判定为同一种属。
二、仔猪腹泻致病菌的药敏试验研究
2.1 常用抗菌药物的筛选与试验设计
在进行药敏试验前,筛选出了养殖业中常用的抗菌药物,除了青霉素类、头孢菌素类、氨基糖苷类外,还包括喹诺酮类(如环丙沙星、恩诺沙星等),因为喹诺酮类药物在治疗仔猪腹泻细菌性疾病方面效果较好。筛选时综合考虑了药物的临床应用频率、抗菌谱以及在当地的使用情况。试验设计采用纸片扩散法作为主要方法,具体操作如下:将纯化后的致病菌菌液用无菌生理盐水稀释至 0.5 麦氏浓度,然后用灭菌棉拭子蘸取菌液,在管壁上挤压去除多余菌液后,均匀涂布在 MH 琼脂培养基表面,每个培养基涂布3 次,每次涂布后将培养基旋转 60∘ ,以保证菌液均匀分布。待菌液吸收 3-5 分钟后,用灭菌镊子将含有一定浓度抗菌药物的纸片按一定间隔(约 24mm )放置在培养基上,轻轻按压使纸片与培养基紧密接触。试验设计中设置了阳性对照和阴性对照,阳性对照采用已知敏感的标准菌株(如大肠杆菌 ATCC25922),阴性对照则在培养基上放置不含抗菌药物的空白纸片,以保证试验结果的准确性和可靠性。将接种后的培养基放入37℃培养箱中培养18-24 小时。
2.2 致病菌对不同抗菌药物的敏感性测定
致病菌对不同抗菌药物的敏感性测定是药敏试验的核心环节。本次试验按照上述 2.1 中的方法准备好培养基后,放入 37∘C 培养箱中培养 18-24 小时。培养结束后,用游标卡尺测量每个药物纸片周围抑菌圈的直径,精确至 0.1mm 。抑菌圈的大小与致病菌对该药物的敏感性呈正相关,即抑菌圈越大,说明致病菌对该药物越敏感。在测定过程中,对每个药物进行3 次重复试验,取平均值作为最终结果,减少试验误差。
2.3 药敏试验结果的标准化判读与分析
通过对药敏试验结果的标准化判读与分析,我们得出以下结论:在参与试验的仔猪腹泻致病菌中,大肠杆菌和沙门氏菌是对仔猪健康威胁较大的主要致病菌。这两种致病菌对青霉素类和头孢菌素类药物的耐药率较高,而对喹诺酮类药物的敏感性相对较好。特别是环丙沙星和恩诺沙星,显示出较强的抗菌活性,有望成为治疗由大肠杆菌和沙门氏菌引起的仔猪腹泻的有效药物。
综上所述,药敏试验结果的标准化判读与分析对于指导临床用药、提高治疗效果具有重要意义。未来,我们将继续深入研究致病菌的药物敏感性变化机制,为制定更加科学合理的治疗方案提供理论依据。
三、仔猪腹泻致病菌研究成果的应用探索
为有效防控仔猪腹泻,需从用药、监测和预防三方面着手。用药上,依据药敏结果制定方案,优先选用高敏感性抗菌药物以提高疗效,中介敏感药物谨慎使用或联合用药,避免使用耐药药物,同时结合仔猪年龄、体重和病情确定剂量与疗程。监测方面,构建养殖场致病菌耐药性监测体系,定期采集样本、分离鉴定致病菌并做药敏试验。预防措施包括针对常见致病菌进行环境消毒,添加益生菌调节肠道菌群,依据当地流行情况制定免疫程序,同时加强人员培训和制度建设,确保措施落实,降低腹泻发生率。
四、结论
本研究通过对仔猪腹泻常见致病菌的分离鉴定、药敏试验及应用探索,明确了常见致病菌的种类及其药物敏感性,为仔猪腹泻的精准防控提供了科学依据。研究成果有助于指导临床合理用药,减少耐药性的产生,同时为养殖场构建耐药性监测体系和制定预防措施提供了参考。通过这些措施的实施,能够有效降低仔猪腹泻的发生率,减少经济损失,提升养殖业的效益。
参考文献
[1]吴允正,陶天宇,张庆生,等.江西地区腹泻仔猪肠道致病菌谱的分析及梭杆菌的分离鉴定[J].中国兽医学报,2022,42(06):1168-1177.
[2]曹晶晶.仔猪腹泻发生的原因及防治措施[J].现代畜牧科技,2022,(04):99-100.
[3]王桂玉.当前仔猪腹泻的防控措施要点分析[J].中国动物保健,2020,22(10):25+28.
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)