天然产物中抗肿瘤活性成分的筛选与机制探讨

潘叶雯
泰州医药集团有限公司
引言
抗肿瘤药物研发的重要源头是天然产物,其有着广泛的来源、多样的结构,蕴藏着众多具备抗肿瘤活性的成分,如生物碱、黄酮、萜类等都包含在内。目前肿瘤治疗遭遇药物耐药性显著、副作用严重等状况。从天然产物中筛选新型的具备抗肿瘤活性的成分,并且剖析其发挥作用的机制,已然成为打破治疗困境的关键途径。然而现有的筛选方式存在效率偏低、容易遗漏活性成分的问题,而且机制探究大多停留在单一通路方面,很难全方位地揭示其作用规律。基于这一情况,本论文展开对天然产物中具有抗肿瘤活性的成分进行筛选,同时探讨其作用机制,以此为提高天然产物在抗肿瘤方面的研究水准、推动药物研发进程提供具备可操作性的方案。
一、天然产物中抗肿瘤活性成分研究的现状及问题
(一)筛选方法效率低且覆盖面有限
眼下天然产物抗肿瘤活性成分的筛选大多依靠传统的体外细胞模型逐个开展测试,每次筛选涵盖的样本数量较少,且所需周期较长,所以难以对天然产物库中的大量样本进行有效筛选。如活性导向分离法等部分筛选方法,虽然能够让活性成分得以富集,但容易受到分离条件的干扰,进而造成含量较低但活性较高的成分出现流失情况。与此同时,现有的筛选模型大多将关注点集中于单一的肿瘤细胞,对于不同种类肿瘤的针对性不够强,很容易遗漏掉具备广泛抗肿瘤活性的成分。
(二)活性成分作用机制研究深度不足
当下已有的机制探究大多聚焦于某一单独的信号通路或者靶点。例如仅仅探究成分对细胞凋亡这一通路所产生的影响,却忽略了其对于细胞周期、代谢以及免疫微环境等多个维度的调节功效。这样具有片面性的机制剖析难以全面展现活性成分的抗肿瘤网络,很难阐释成分在生物体内的复杂作用进程,同时也对基于机制的药物优化与改良造成了限制。
(三)活性成分活性验证与评价体系不完善
有一部分研究仅仅借助体外的细胞实验来验证活性成分的抑制成效, 并未开展针对体内动物模型的验证工作,所以难以切实反映出成分在生物体内部的吸收、分布、代谢 排泄 抗肿瘤活性。并且评价的指标较为单一,大多是以细胞存活率作为核心内容,缺少对于肿瘤转移、复发抑制 成 毒 方面的评估,因此很难全方位地判断成分具备的成药潜力。
(四)天然产物资源利用与活性成分挖掘不充分
天然产物具备丰富的资源储备,然而有一部分处于稀缺状态或者获取难度较大的天然产物,如深海生物、珍稀植物等,至今还未开展系统性的研究工作,进而造成了资源的浪费状况。与此同时,针对已知天然产物所开展的结构修饰以及衍生物研究工作不够充分,没有借助结构优化的方式来增强其抗肿瘤的活性,同时降低其毒性,从而对天然产物活性成分的开发和应用范围形成了限制。
(五)筛选与机制研究数据联动不足
在筛选进程中所产生的众多数据,如成分的结构状况、活性的强弱程度等,以及机制探究方面的数据,例如靶点的结合能力、通路的调控成效等,大多处于零散存放的状态,并未构建起关联分析的体系。难以借助数据之间的联动迅速确定具备“高活性且机制清晰”特征的优势成分,同时也很难凭借数据分析去预估成分可能存在的作用靶点,这就使得研究的效率以及精准程度有所降低。
二、天然产物中抗肿瘤活性成分的筛选方法优化
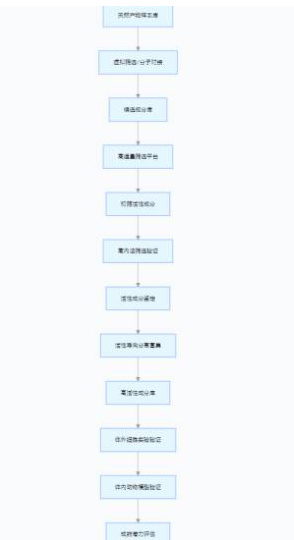
(一)构建高通量筛选与高内涵筛选联用体系
构建具备高通量特性的筛选平台,运用自动化的液体处理手段以及微型化的细胞模式,达成单次对数量在数千到上万种天然产物样本的迅速筛选工作,显著提高筛选的效能。并且,将高内涵筛选技术加以结合,凭借荧光标记多个靶点的方式,同时检测活性成分针对肿瘤细胞的形态、凋亡比率、信号分子表达等多个指标所产生的影响,达成针对活性成分的多维度初步筛选,降低高活性成分被遗漏的可能性。
(二)引入虚拟筛选与分子对接辅助筛选
借助计算机开展的虚拟筛选技术,以已知的具有抗肿瘤作用的靶点,如 P53、EGFR 等靶点的具体结构作为基础,搭建起分子对接的模型。接着针对天然产物数据库开展虚拟对接并进行评分操作,优先将与靶点之间具备较高亲和力的候选成分筛选出来。通过运用虚拟筛选的方式,能够让实验筛选的范围得以缩小,还能够使实验所需要的成本有所降低。与此同时,将体外实验结合起来,对虚拟筛选所得到的结果加以验证,进而形成一种名为“虚拟预测-实验验证”的高效率筛选模式,让筛选的精准程度得到提升。
(三) 开发针对不同肿瘤类型的特异性筛选模型
面向肺癌、乳腺癌、肝癌等多种相异类型肿瘤所呈现的分子特性,搭建具备特异性的筛选模型。譬如,对于激素受体呈阳性的乳腺癌,构建以雌激素信号通路为依赖的肿瘤细胞模型;就肝癌而言,打造携带有 HBV 整合片段的细胞模型。借助特异性模型开展筛选工作,能够有目的地探寻出对特定种类肿瘤具备高效抑制功效的活性成分,增强筛选工作的针对性以及实用性。
(四)优化活性导向分离与富集技术
对传统的活性导向分离法予以改进,将超高效液相色谱-质谱联用技术等现代分离技术结合进来,达成对天然产物提取物的迅速分离以及成分的鉴定工作。运用制备型色谱技术来富集含量较低的活性成分,与此同时,借助在线活性检测系统对分离组分的抗肿瘤活性进行实时的监测,防止活性成分由于在分离过程之 出现降解或者流失的情况而被忽略掉,从而提高活性成分的获取效率,如图一所示。
三、天然产物抗肿瘤活性成分作用机制的多维度解析
(一)解析活性成分对肿瘤细胞凋亡与自噬的调控机制
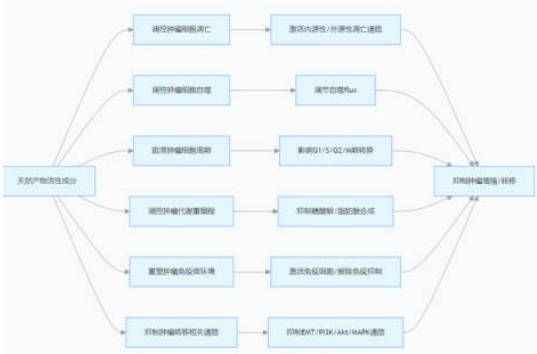
运用 Western blot、实时荧光定量 PCR 等相关技术,对活性成分在凋亡相关蛋白,例如 Bax、Bcl-2 以及自噬标志物,如 LC3、p62 表达方面所产生的影响予以检测,以此来确定成分是否借助激活内源性或者外源性的凋亡通路,进而诱导肿瘤细胞的死亡,抑或是否通过对自噬 flux 进行调控,从而影响肿瘤细胞的存活状况。与此同时,对凋亡和自噬之间的相互作用展开探索,进而揭示相关成分针对凋亡和自噬这两种细胞死亡方式所呈现出的协同调控规律。
(二)研究活性成分对肿瘤细胞周期与代谢重编程的影响
借助流式细胞术这一方法,来分析活性成分对于肿瘤细胞周期各个阶段,具体为 G1 期、S 期、G2/M 期分布所产生的影响。同时,检测周期调控蛋白,例如 Cyclin、CDK 等蛋白表达的变化情况,以此来明确该成分是否是通过对细胞周期进行阻滞,进而达到抑制肿瘤增殖的目的。利用代谢组学技术,对成分在肿瘤细胞糖酵解、脂肪酸合成等代谢途径方面的调控情况展开分析,从而揭示其借助代谢重编程来抑制肿瘤能量供应的作用机理。
(三)探讨活性成分对肿瘤免疫微环境的调节作用
借助肿瘤荷瘤小鼠模型,对活性成分给肿瘤微环境中免疫细胞,如 T 细胞、巨噬细胞、树突状细胞的数量以及功能所产生的影响予以检测,剖析细胞因子,例如 IL-2、TNF-α的分泌变动情况。探究成分是否能够经由激活免疫细胞,抑制免疫抑制细胞,比如 Treg 细胞,或者解除免疫检查点,例如 PD-1/PD-L1 的抑制作用,来对抗肿瘤免疫微环境进行重塑,进而发挥免疫协同抗肿瘤的功效。
(四)分析活性成分对肿瘤转移相关通路的抑制机制
凭借 Transwell 迁移实验以及划痕愈合实验,来检测活性成分对于肿瘤细胞迁移能力和侵袭能力所产生的影响。运用蛋白质组学技术,对成分发挥作用之后出现差异表达的蛋白进行筛选,着重剖析其针对 EMT 相关蛋白,如 E-钙粘蛋白、N-钙粘蛋白以及转移相关信号通路,例如 PI3K/Akt、MAPK 通路的调控状况,从而明确成分抑制肿瘤转移的关键分子机制,如图二所示。
图二:天然产物抗肿瘤活性成分的作用机制关联图
结束语
本文借助对天然产物中具有抗肿瘤活性的成分开展筛选工作,并且对其作用机制进行探究,从而清晰地认识到当下研究存在着一系列问题,如筛选的效率较为低下、机制的解析不够深入、验证体系不够健全、资源的利用不够充分等。并且,从优化筛选方法、进行多维度机制解析这两个方面给出了解决措施。研究显示,科学合理的筛选以及深入透彻的机制研究,可以切实地促进天然产物中抗肿瘤活性成分的挖掘以及应用,为药物的研发提供强有力的支撑。然而本研究并未深入探究极端环境下天然产物,如极地植物、深海微生物等的活性成分筛选工作,并且在成分的结构修饰以及衍生物活性提升方面的研究存在欠缺。在未来能够结合特殊资源的特性来对筛选策略予以优化,强化结构改造方面的研究,从而为天然产物抗肿瘤药物的研发给予更为全面的技术支撑,推动肿瘤治疗领域实现创新性的发展。
参考文献:
[1]张剑.红豆杉种子中抗肿瘤活性成分的筛选及纳米胶束的制备[D].江苏大学,2023.
[2]徐兴阳,徐宁,李久明,等.天然产物中抗肿瘤活性成分研究新进展[J].内蒙古民族大学学报(自然科学版),2022,37(01):26-2
[3]路洋洋.沙棘叶结合态多酚中抗肿瘤活性成分的分离纯化及成分分析[D].山西大学,2020.
[4]刘伟婷.基于分子印迹及分子对接双策略技术研究苦豆子中抗肿瘤活性成分[D].江西中医药大学,2019.
[5]李慧娟,赵玉丛,樊国燕,等.天然产物中抗肿瘤活性成分的研究进展[J].现代牧业,2018,2(03):31-34.
图一:天然产物中抗肿瘤活性成分多维度筛选流程图
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)