基于MR静脉期影像组学特征预测胃癌HER2表达状态的研究

彭容 张泽明 王智清 李斌 青丽萍 王金星
攀枝花市中心医院医学影像中心 放射影像科 四川攀枝花 617067;攀枝花市中心医院 疼痛科 617067
胃癌占全球癌症相关死亡的第三位[1],许多患者确诊时已经在胃癌晚期[2,3],已失去了根治性手术的机会[1,4]。人表皮生长因子受体2(Human epidermal growth factor receptor 2,HER2)在正常人群中极低表达,而在许多恶性肿瘤中高表达[4]。HER2的过度表达是胃癌的不良预后因素[2,4]。靶向药物曲妥珠单抗联合标准化疗能显著改善HER2阳性晚期胃癌的生存率[1,2]。因此,明确胃癌患者HER2表达状态对患者的个体化精准治疗非常重要。胃镜活检或手术标本进行免疫组织化学分析可评价HER2表达状态,但其有创且成本高。因此,发现相对非侵入性和可接受性检测胃癌患者HER2表达状态是一种有效的方法紧迫的任务。
以往胃影像组学主要集中于CT,在MR方面则多集中在运用DWI[5]序列、T2WI序列[6], 而在增强MRI序列方面的研究起步较晚。 目前仅查见少数增强MR在胃癌病理分期及生存分析中的应用[7-8],张等[5]运用增强MRI直方图分析预测胃癌HER2表达,Ktransperc75预测的AUC值达0.802。文献报道CT影像组学特征与胃癌HER2表达状态具有相关性[2,3]。本研究探讨基于术前静脉期MR影像组学特征是否可以有效识别出胃癌的HER2表达状态,为临床预测HER2表达状态提供影像组学方法,从而方便临床制定出更合理的治疗方案,进一步改善患者的生活质量。
1 材料与方法
1.1研究对象
收集2021年1月-2023年11月攀枝花市中心医院经病理确诊的胃癌患者进行回顾性研究。纳入标准:(1)术后或胃镜活检病理证实为胃腺癌;(2)术前或活检1个月内行胃低张MR增强扫描的患者;(3)对病理组织进行免疫组化检测评估术后HER2状态。排除标准:(1)临床信息不完整;(2)病理类型为印戒细胞癌或粘液腺癌;(3)术前给予了治疗的患者;(4)MR图像质量差,最长直径小于5mm。记录患者的性别、年龄、CEA、CA724、分化程度、胃癌的厚度和长度、病理T分期、有无淋巴结转移、胃癌的位置。本研究获院伦理委员会批准(2024-010),检查前患者均知情同意。
最终157例患者纳入本研究,其中男97例,女60例,年龄58.75±11.85岁(年龄范围为19 -95岁)。
1.2MR扫描和数据测量
MRI检查前,所有患者禁食至少8小时排空胃肠道,如无东莨菪碱丁基溴使用禁忌症(如青光眼、前列腺肥大和严重心脏病)在MR检查前10分钟肌内注射东莨菪碱丁基溴20毫克以减少肠胃蠕动。在MR检查前5分钟内口服温水800-1000 ml以填满胃腔。
所有患者均使用32通道相控阵体线圈的3.0 T磁共振扫描仪(Discovery MR750, GE, USA)进行全腹平扫和动态对比增强MR。
行多期高分辨率容积增强T1WI扫描时使用高压注射器经肘静脉注射Gd-DTPA 15-20 ml,注射速度2-2.5 ml/s,扫描参数如下:TR/TE,4ms / 2ms; FA,12;matrix,260 × 192; FOV 36 cm×36-40 cm×40 cm;层厚/间距,5mm/0mm。
测量轴位图像中肿瘤垂直于胃壁周缘的最长径(肿瘤最厚径)及其在最大截面上的最长径。
1.3评估HER2表达状态
采用免疫组织化学和荧光原位杂交检测胃癌病理标本来确定HER2表达状态,若免疫组织化学染色评分达到3+、或2+且荧光原位杂交检测阳性,则判定为HER2表达阳性;免疫组织化学评分为0、1+或2+且荧光原位杂交检测阴性,判定为HER2表达阴性[4]。
1.4病灶分割和特征提取
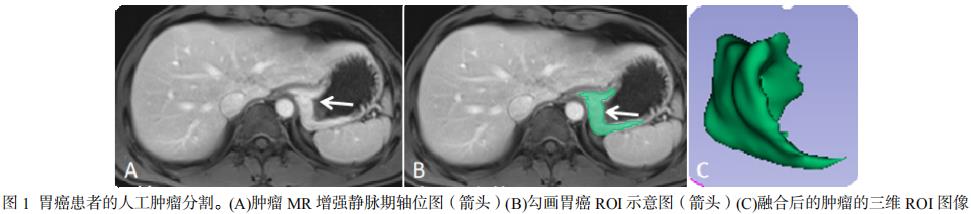
下载并导出研究对象的图像通过图片存档和通讯系统(PACS)并导入到3D-Slicer软件中。两名从事放射诊断10年的医师(观察员1和观察员2)随机选择40例胃癌患者在轴位静脉期图像上描绘患者3D感兴趣的体积(3D-VOI)(图1),提取其影像组学特征。计算2名医师提取结果的组内相关系数(intra-class correlation coefficient, ICC)。对于每个ROI总共从原始图像中提取了1130个特征,包括基于形状的,纹理的,直方图和小波的特征。
1.5特征筛选
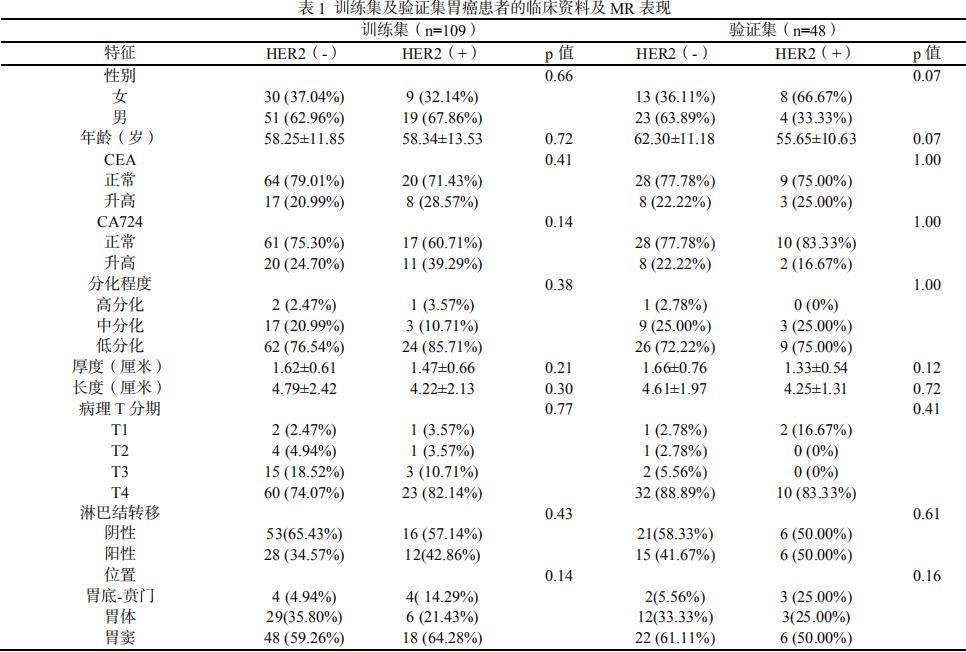
保留一致性选择ICC≥0.75(即稳定特征)的特征;对特征数据进行标准化处理;将157例胃癌患者,其中Her2 阳性40例、阴性117例,按7:3比例随机将其分为训练集(n=109)和验证集(n=48);采用随机森林和十折交叉验证进行特征筛选。
1.6评估模型建立
采用随机森林建立影像组学模型。绘制受试者工作特征(receiver operating characteristic, ROC)曲线,以曲线下面积(area under the curve, AUC)及准确率等指标评估模型效能。绘制校准曲线,观察模型预测概率与真实概率的一致性;绘制决策曲线评估模型能否带来临床净获益。
1.7统计学分析
采用SPSS13.0和R语言软件(4.4.1)进行统计分析。符合正态分布计量资料以均数±标准差表示,采用独立样本t检验;不符合正态分布者,采用Mann-Whitney U检验或Fisher确切概率法。计数资料用数量(率)表示,以卡方检验比较计数资料。P<0.05为差异有统计学意义。
2. 结果
2.1临床资料 训练集和验证集Her2阳性和阴性差异均不具有统计学差异(P均>0.05),见表1。
2.2影像组学特征
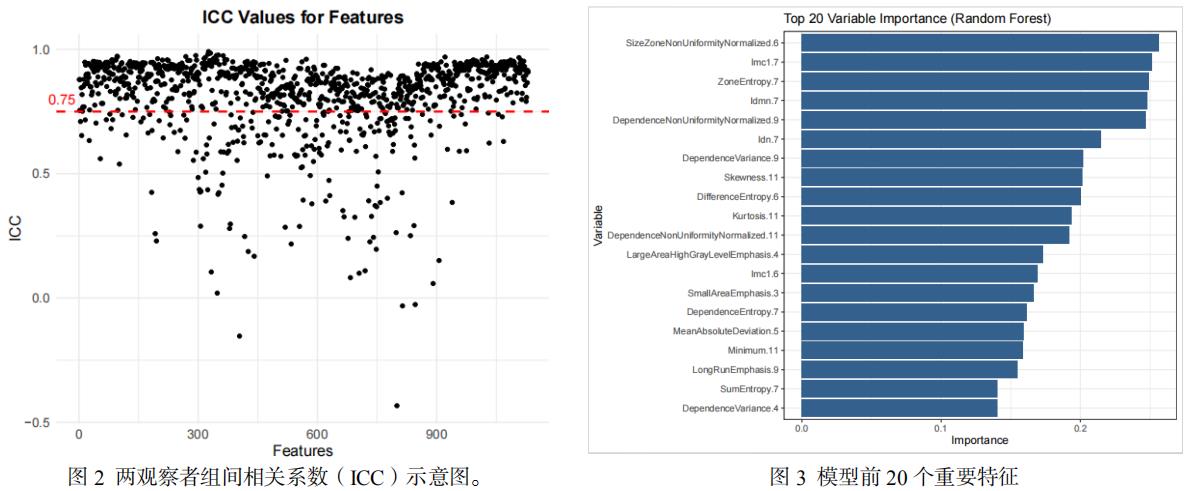
将ICC>0.75的904个特征保留(图2);采用随机森林法对影像特征进行了独立的特征筛选和重要性排序(图3)。选取了影像模型筛选的前20个特征进行建模。对建模所需参数采用十折交叉验证结合网格搜索的方法对超参数进行优化(表2)。
2.3模型效能
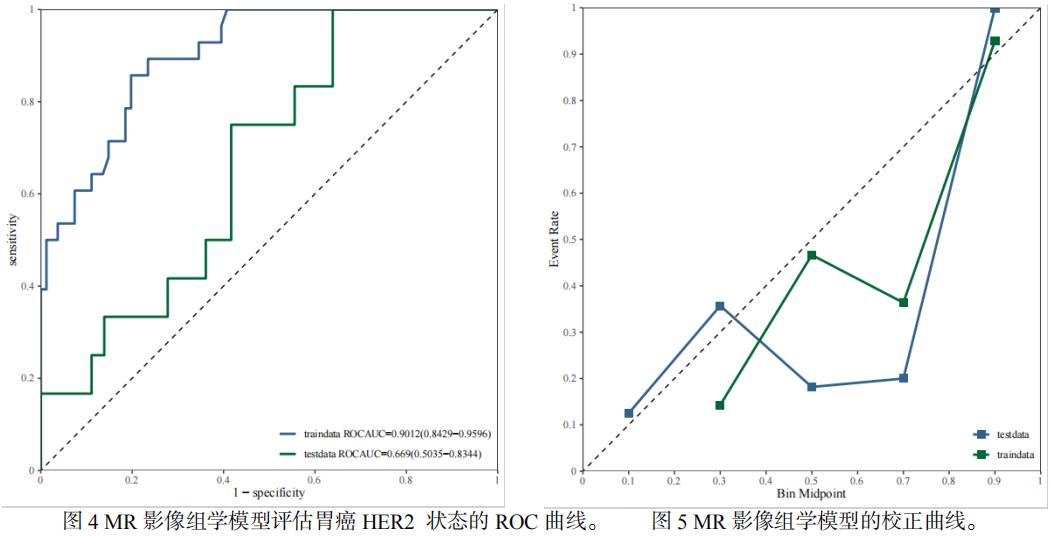
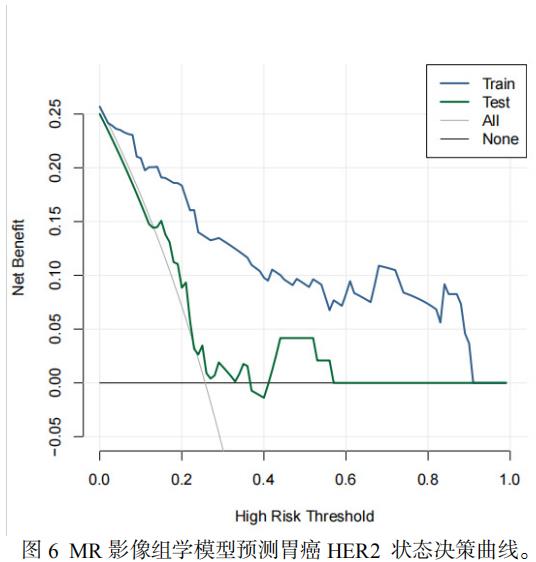
基于MR静脉期影像组学模型评估训练集胃癌HER2表达的曲线下面积(AUC)为0.9012(95%CI: 0.8429–0.9596),测试集AUC为0.6696(95%CI: 0.5035–0.8344)(图4)。校准曲线显示,训练集预测值与实际结果基本一致,而在测试集上校准度下降(图5)。DCA显示,在训练集净获益良好,在测试集上净获益有限(图6)。

3 讨论
HER2阳性胃癌预后差,复发率高[4,9]。靶向药物曲妥珠单抗联合标准化疗能显著改善HER2阳性晚期胃癌的生存率[1,2]。因此,明确胃癌HER2表达状态有利于治疗方案的选择。目前HER2的检查采用免疫组织化学分析而获得,为有创检查。
既往MR影像组学模型主要集中在对胃癌的TNM分期、生存分析及新辅助化疗方面的评价[7],采用的序列主要为DWI、T2WI、增强MR。张等[5]采用动态对比增强直方图分析预测胃癌HER2的表达,发现Ktransperc75预测HER2阳性的AUC值达0.802。
本文采用无创的方法,构建并验证了基于MR静脉期影像组学特征预测胃癌Her2表达,发现训练集和验证集预测胃癌 HER2表达状态的曲线下面积(AUC)分别为0.9012、0.669。为临床了解Her2表达提供参考价值,从而辅助及时开展胃癌靶向化疗、推进个体化治疗以及改善患者预后。
既往研究显示HER2表达与患者性别、年龄、CEA、肿瘤位置、分化程度、肿瘤最大径、肿瘤厚度无显著相关性[10,11],与本研究结果基本相同。有研究显示CA724是HER2阳性表达的独立危险因素[2],而本研究发现CA724与HER2的表达无显著相关性,这可能与样本的组成有关。另外本研究还提示病理T分期及N分期与胃癌的HER2表达无显著相关性。
CT影像组学预测HER2表达的报道较多[2,3,11]。所选取的期相包括动脉期、门静脉期,预测效能AUC值从0.703-0.921不等。张等[5]采用动态对比增强直方图分析预测胃癌HER2的表达,回顾性分析65例经手术病理证实的胃癌患者,发现动态增强直方图参数Ktransperc75预测HER2阳性的AUC值达0.802。本研究基于MR静脉期影像组学模型在评估训练集胃癌HER2表达的AUC为0.9012(95%CI: 0.8429–0.9596),测试集AUC为0.6696(95%CI: 0.5035–0.8344)。校准曲线显示,训练集预测值与实际结果基本一致,而在测试集上校准度下降。DCA显示,在训练集净获益良好,在测试集上净获益有限。
本研究的局限性:①HER2表达阳性病例相对较少,可能会导致模型的不稳定,降低模型的可靠性和泛化性,因此需进一步扩大样本量来提高模型的可靠性和泛化能力。②本研究为单中心回顾性研究,难以避免选择偏倚,且缺乏外部验证。
总之,基于MR静脉期影像组学特征可有效预测胃癌Her2表达,为临床了解 Her2表达提供参考价值,从而辅助及时开展胃癌靶向化疗、推进个体化治疗以及改善患者预后。
参考文献
[1] Bray F, Laversanne M, Sung H, et al. Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2024 May-Jun;74(3):229-263.
[2] Guan X, Lu N, Zhang J. Evaluation of Epidermal Growth Factor Receptor 2 Status in Gastric Cancer by CT-Based Deep Learning Radiomics Nomogram. Front Oncol. 2022 Jul 11;12:905203.
[3] Zhao H, Liang P, Yong L, Cheng M, et al. Development and external validation of a radiomics model for assessment of HER2 positivity in men and women presenting with gastric cancer. Insights Imaging. 2023 Feb 1;14(1):20.
[4] Ajani JA, D'Amico TA, Bentrem DJ, et al. Gastric Cancer, Version 2.2022, NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2022 Feb;20(2):167-192.
[5] 张霄,曲金荣,张宏凯,等.动态对比增强MRI定量参数直方图分析在胃癌HER2表达中的应用价值[J].放射学实践,2021,36(09):1110-1115.
[6] Qiao X, Li Z, Li L, et al. Properative T2-weighted MR imaging texture analysis of gastric cancer: prediction of TNM stages. Abdom Radiol (NY). 2021 Apr;46(4):1487-1497.
[7] Chen W, Gao C, Hu C, et al. Risk Stratification and Overall Survival Prediction in Advanced Gastric Cancer Patients Based on Whole-Volume MRI Radiomics. J Magn Reson Imaging. 2023 Oct;58(4):1161-1174.
[8]闫亮亮.DCE-MRI的全肿瘤直方图分析参数评估可切除胃癌不同病理特性的应用研究[D].郑州大学,2022.
[9]Janjigian YY, Shitara K, Moehler M, et al. First-line nivolumab plus chemotherapy versus chemotherapy alone for advanced gastric, gastro-oesophageal junction, and oesophageal adenocarcinoma (CheckMate 649): a randomised, open-label, phase 3 trial. Lancet. 2021 Jul 3;398(10294):27-40.
[10] Zhang X, Wang M, Wang Y,et al. Clinicopathologic significance of Her-2 and P53 expressions in gastric cancer. Asian J Surg. 2023 Jan;46(1):526-531.
[11] 任梦婷,陈基明,昌杰,等.基于CT生境影像组学和深度学习模型预测进展期胃癌HER2表达状态的价值[J].放射学实践,2025,40(04):501-508.
第一作者简介:彭容,1986年10月出生,女,四川乐山人,副主任医师,硕士,主要研究方向:腹部影像学,消化系统疾病MR诊断。E-mail:396013539@qq.com
通讯作者:王金星,1984年4月出生,男,湖北利川人,副主任医师,本科,主要研究方向:腹部疼痛学,E-mail:314619295@qq.com,
基金:2023年度攀枝花市市级指导性科技计划项目,项目编号2023ZD-S-12
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)